1.Techniques utilisant les enzymes
A. Immuno-enzymologie
A1.ELISA : Enzyme-linked immunosorbent assay.
Les techniques immunologiques ont longtemps employé la radioactivité pour révéler la présence d’un complexe immun dans un échantillon. Cette technique nécessite la manipulation et la gestion de produits/déchets radioactifs, ce qui peut poser problème à long terme. A la fin des années 60, Avrameas et Pierce développent une méthode pour fixer des enzymes sur des anticorps via le glutaraldéhyde. C’est le début de l’immuno-enzymologie.
En 1971, Perlmann et Engvall mettent au point la méthode ELISA, qui est la plus utilisée maintenant.
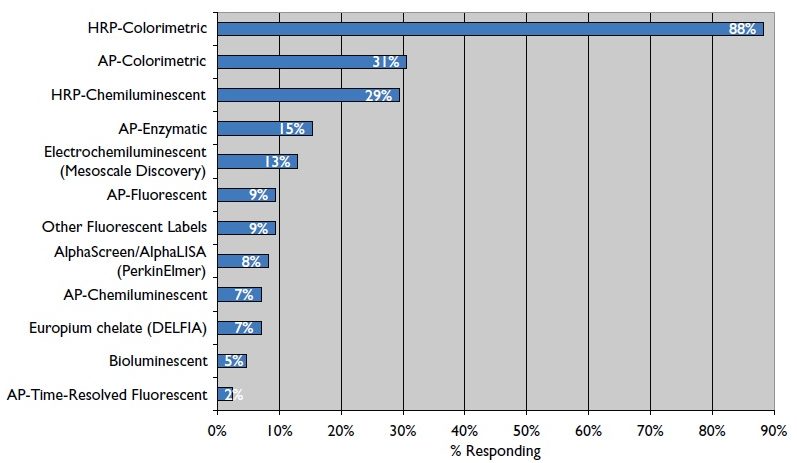
Quelles sont les enzymes utilisées en ELISA ?
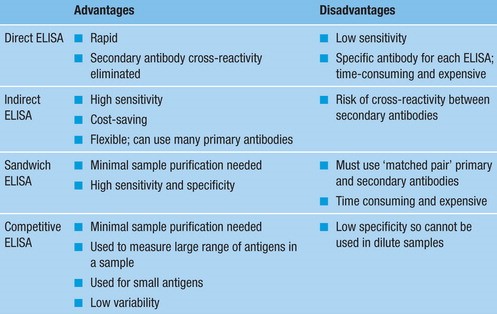
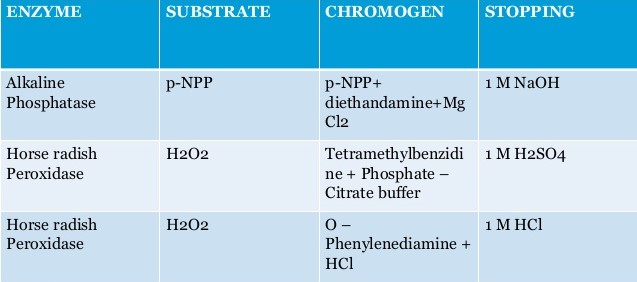
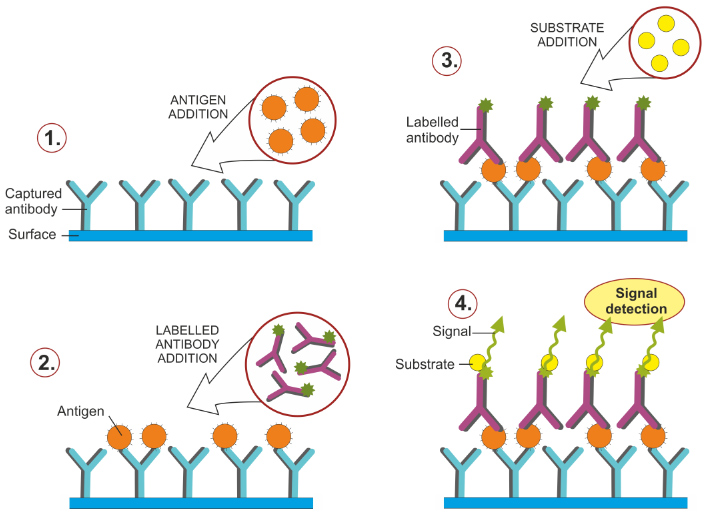
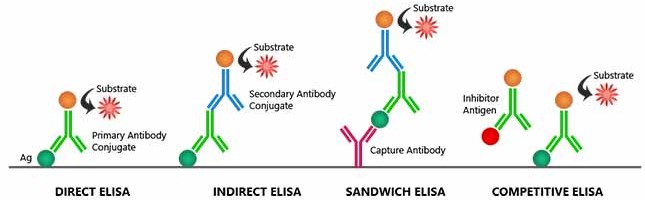
Durant la réalisation d’un ELISA, l’ordre des étapes doit être scrupuleusement respecté et les lavages, très nombreux, sont déterminants pour la qualité finale de la réaction. L’ELISA est réalisé en microplaque, et les résultats sont lus à l’aide d’un lecteur de microplaque.
Protocole pour un ELISA-indirect
- Coating des antigènes (antigène A) au fond des puits de microplaque ;
- Lavage : éliminer les antigènes non-fixés ;
- Saturation des sites non-liés par une protéine, généralement de la BSA ;
- Lavage : éliminer la BSA non-fixée ;
- Dépôt du sérum du patient dans les puits : si l’anticorps reconnaissant l’antigène A est présent, il se fixe ;
- Lavage : éliminer les anticorps non-fixés ;
- Dépôt de l’anticorps secondaire, couplé à l’enzyme. L’anticorps reconnaît le fragment Fc de l’anticorps du patient et s’y fixe ;
- Lavage : éliminer les anticorps secondaires non-fixés ;
- Ajout des substrats de l’enzyme : activation du système-rapporteur ;
- Ajout de la solution d’arrêt après 5-10 min de réaction enzymatique
- Lecture des absorbances.
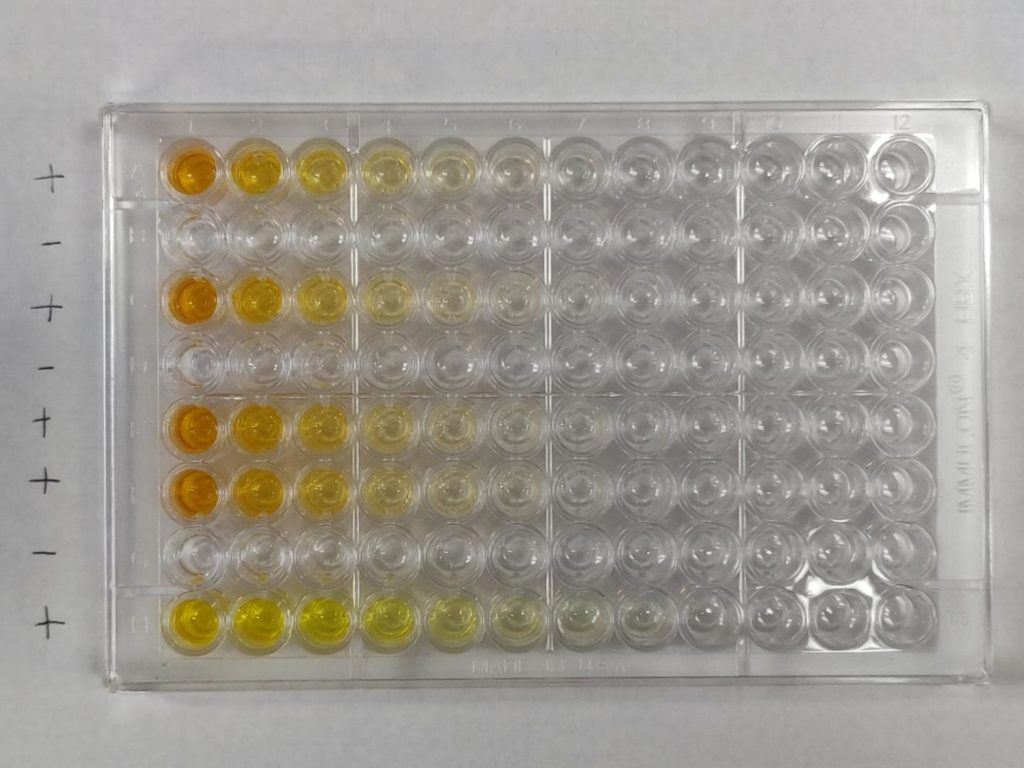
La méthode ELISA est principalement utilisée dans les laboratoires d’analyse médicale pour rechercher des anticorps dans le sérum d’un patient (sérologie), détecter des antigènes (protéines virales, toxines bactériennes, …) , mais également pour la caractérisation des épitopes d’anticorps monoclonaux ou leur isotypage (classe d’anticorps).
A2.Autres méthodes
Immunofixation/dot-blot./immunoblot/western-blot : l’antigène est préalablement adsorbé sur une membrane (cellulose ou agar) et repéré par l’utilisation d’un anticorps primaire ou secondaire, couplé à une enzyme. Ces tests sont surtout employés en activité de recherche ou de diagnostic (confirmation VIH par western-blot). Les antigènes sont préalablement séparés par des techniques de migration passive, ou active comme l’électrophorèse (western-blot).
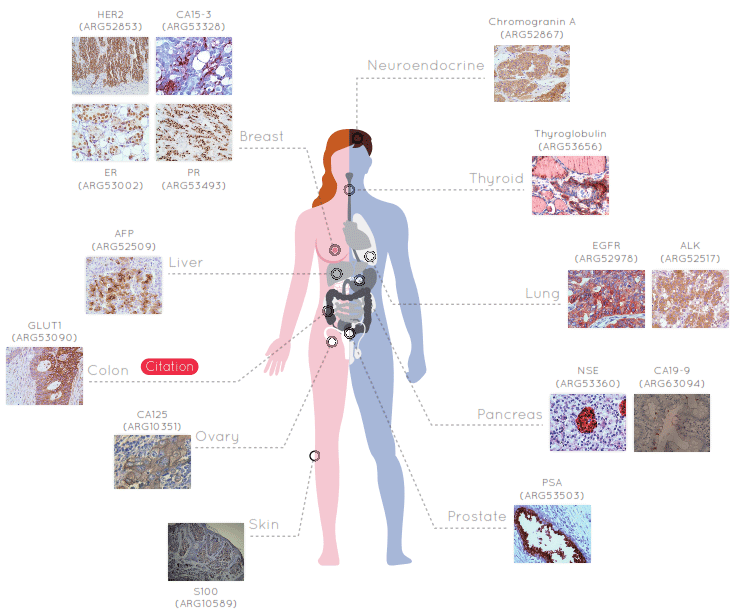
Immunohistochimie : marquage d’une protéine in situ (directement sur une lame de tissu), grâce à un anticorps couplé à une enzyme (primaire) ou repéré par un second anticorps couplé à une enzyme (secondaire). Cette approche est également utilisée en recherche et en diagnostic, comme la recherche de cellules cancéreuses.
B. Les enzymes immobilisées
B1.Introduction
L’usage quasi-systématique d’enzymes dans les Biotechnologies a forcé la recherche à développer de nouvelles stratégies d’utilisation de ces protéines. Les principaux problèmes rencontrés étaient :
- L’enzyme se retrouve mélangée au produit final, donc elle est contaminante du produit ;
- L’enzyme est techniquement perdue, sauf à mettre en place des techniques de purification complexes ;
- L’enzyme est potentiellement dangereuse pour la santé, comme cela était le cas dans les lessives, il y a une cinquantaine d’années.
Tous ces points ont conduit au développement de techniques d’encagement des enzymes, lors des processus biotechnologiques. On parle alors d’enzymes immobilisées ! Cette stratégie permet :
- « D’isoler » l’enzyme du milieu réactionnel : elle ne circule plus dedans. Elle est ainsi plus stable dans le temps, moins dégradée ;
- De retirer facilement l’enzyme du milieu réactionnel : elle ne contamine plus le produit final, elle peut être ré-utilisée et recyclée facilement ;
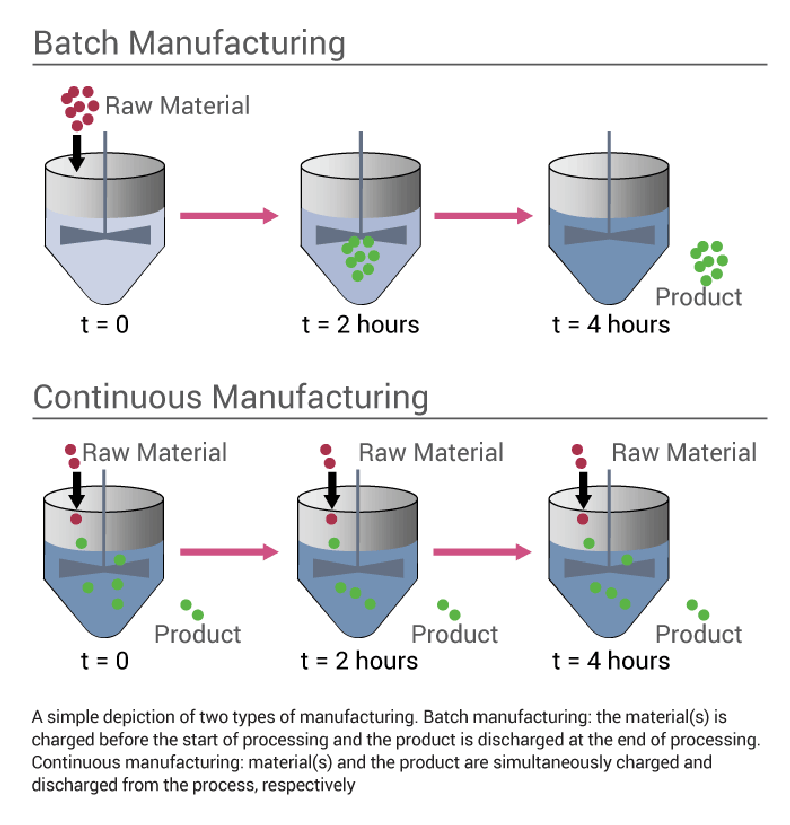
- Elle permet un fonctionnement de production en continu (plus adaptée aux exigences de production industrielle), alors que la production était surtout réalisée en batch avant les enzymes immobilisées.
B2.Stratégies d’immobilisation
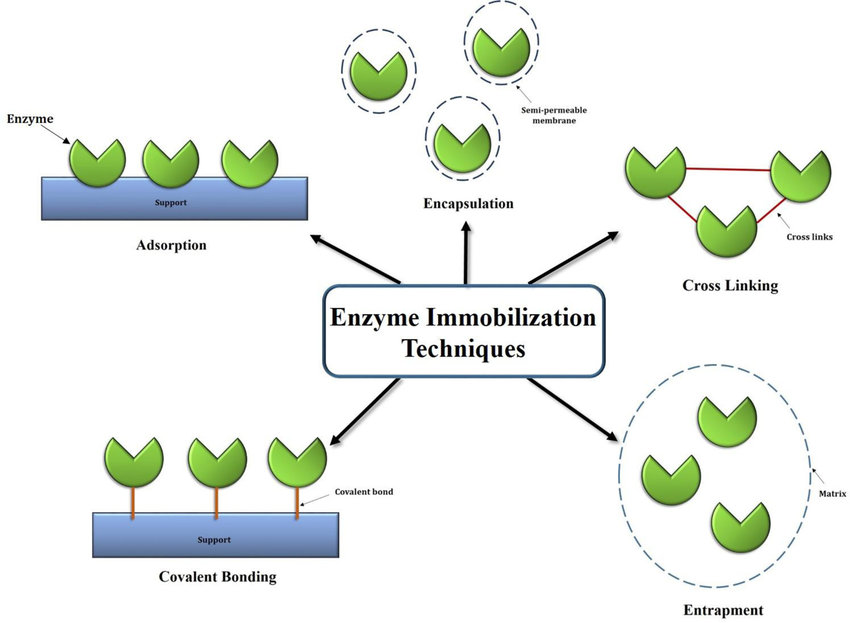
B3.Propriétés cinétiques des enzymes immobilisées
L’éloignement de l’enzyme de son substrat, notamment dans les cas des enzymes réticulées ou encapsulées, provoquent un « retard » d’accès du substrat vers l’enzyme. Ceci se traduit par une augmentation de la valeur de Km, mais également une diminution de la Vmax
Autres propriétés modifiées par l’immobilisation :
B4.Applications des enzymes immobilisées
- Diagnostic : surfaces imprégnées d’enzyme pour la détection d’hormone, de cholestérol, …
- Clinique : encapsulation d’enzyme pour le traitement de déficiences enzymatiques, et les protéger d’action de protéases (traitement des maladies lysosomiales).
- Agroalimentaire : élimination de lactose du lait, …
Détail des applications :

Le développement des enzymes immobilisées a abouti à la production des biocapteurs.
C. Les biocapteurs
2.Applications analytiques
Voir TD
