Table des matières
- Introduction
- I. Les acides gras
- II. Les glycérolipides
- III. Les sphingolipides
- IV. Les cérides
- V. Les lipides polyisopréniques
Rappels de biochimie
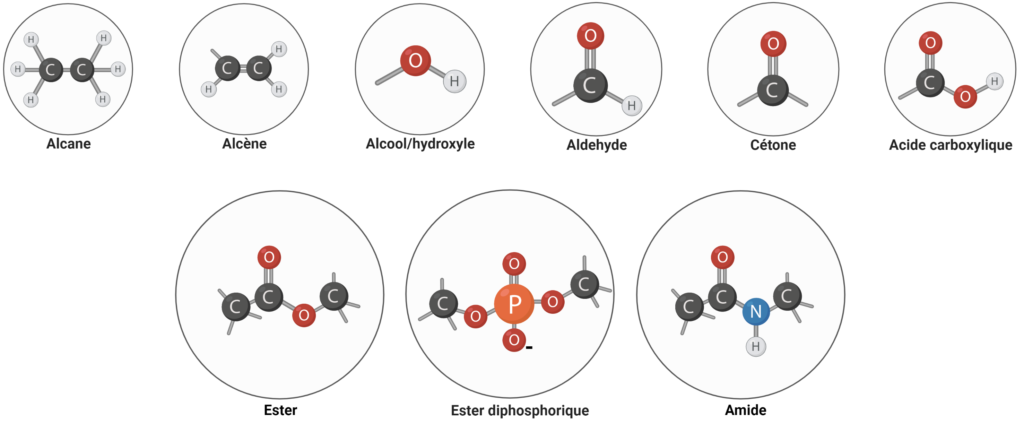
Introduction
- Les lipides sont très hétérogènes ;
- Structures très variables, sans aspect consensuel : on estime qu’un lipide est une molécule possédant un chaîne aliphatique de plus de 8 atomes de carbone à la suite. Cette propriété ne permet pas de couvrir tous les lipides, puisque certains acides gras ne présentent que 4 atomes de carbone…
- Très diversifiés dans le vivant : on estime qu’il existe plusieurs milliers de lipides différents.
Note : lipides simples vs complexes.
- Lipides simples : ils ne contiennent que du C, du H et O ;
- Lipides complexes : des atomes supplémentaires apparaissent comme P ou N.
I. Les acides gras
- Les acides gras se caractérisent par une chaîne aliphatique de 4 à 40 atomes de carbone, et présentent tous une fonction carboxylique terminale ;
- Certain acides gras ont une chaîne aliphatique saturée, sans double-liaison entre les atomes de carbone : la formule générale des acide gras insaturés est : CH3 – (CH2)n – COOH (avec 2 < n < 22 dans la majorité des cas) ;
- Certains acides gras ont une chaîne aliphatique désaturée, avec une ou plusieurs doubles-liaisons entre les atomes de carbone constituant la chaîne aliphatique. Il n’y a pas de formule générale dans ce cas, compte-tenu des variations possibles. On distingue les acides gras monodésaturés = 1 seule double-liaison ; et les acides gras polydésaturés = plusieurs doubles-liaisons ;
- Généralement, et cela est liée au processus de biosynthèse des acides gras, le nombre d’atomes de carbone est quasiment toujours pair. On peut trouver plus rarement des acides gras à nombre d’atomes de carbone impaire ;
- Les acides gras sont généralement impliqués dans des structures moléculaires plus complexes, par l’intermédiaire de liaisons ester ou amide (impliquant la fonction carboxylique) et rarement à l’état libre.
- Dans certains cas, la chaîne aliphatique peut être modifiée : par hydroxylation (cires végétales, glycolipides animaux ou intermédiaires de la ß-oxydation), ou ramification (acide phytanique chez les bactéries halophiles ou thermophiles).
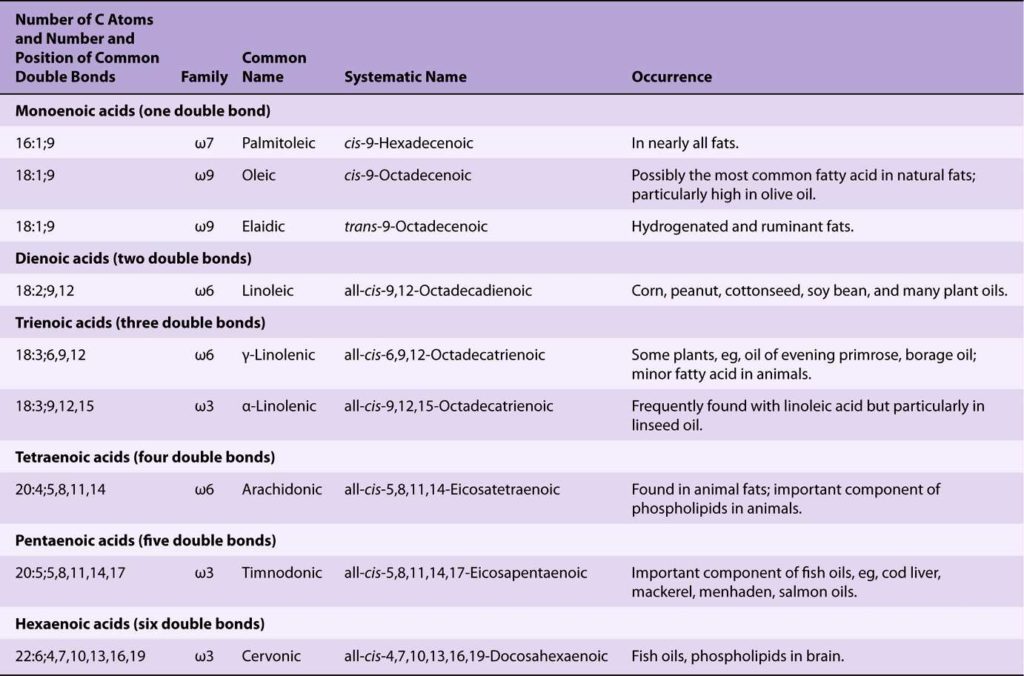
I.A. Les acides gras saturés
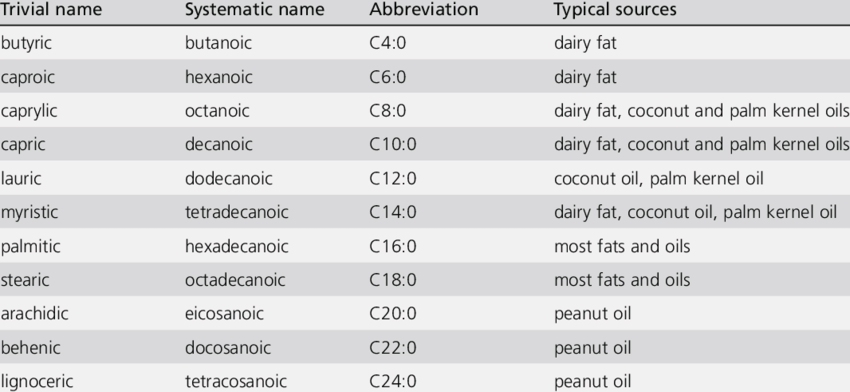
- Les acides gras (AG) les plus fréquents sont l’acide palmitique et l’acide stéarique ;
- Dans les produits laitiers, on trouve essentiellement des AG à courte chaîne ;
- Dans les huiles, on trouve essentiellement des AG à longue chaîne.
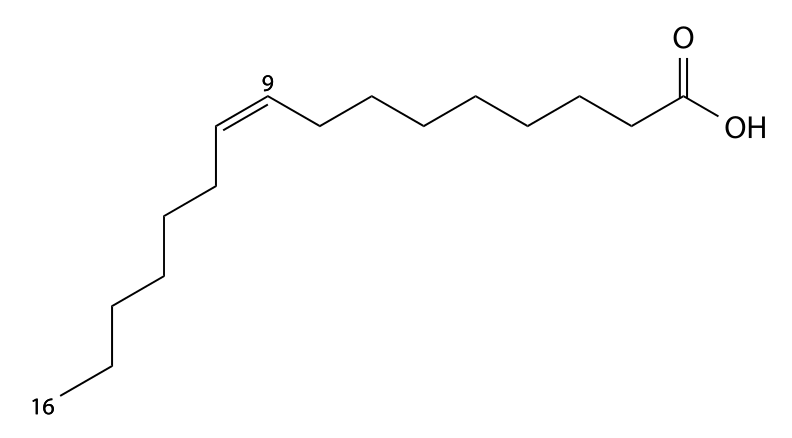
I.B. Les acides gras monodésaturés
- Les AG monodésaturés présentent une seule double-liaison dans leur chaîne aliphatique ;
- Notation : le carbone de la fonction carboxylique est noté 1. On remonte la chaîne aliphatique jusqu’à rencontrer le premier atome de carbone impliqué dans la liaison-double, et on note sa position : C16, ∆9 OU C16 : 1 (9) ;
- On peut également utiliser la notation : 16 ω 7. Dans ce cas, le chiffre suivant le symbole ω correspond au numéro de l’atome de carbone, en partant dans le sens inverse de la nomenclature normale.
I.C. Les acides gras polydésaturés
- Les AG polydésaturés contiennent plusieurs doubles-liaisons ;
- Ces doubles-liaisons sont généralement séparées par 3 atomes de carbone : ··· CH = CH – CH2 – CH = CH ··· ;
- La nomenclature reprend les règles des AG monodésaturés : C20, ∆5,8,11,14 OU C20 : 4 (5, 8, 11, 14) ;
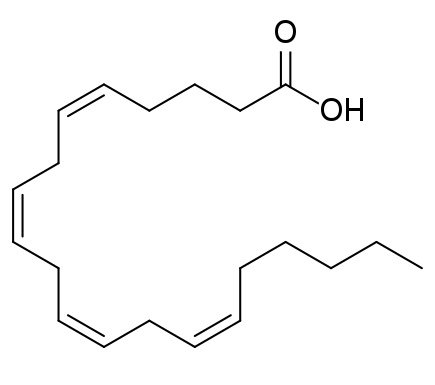
- La nomenclature basée sur la notation ω prend en compte deux éléments : la position de la première double-liaison (toujours en sens inverse de la notation classique) et le nombre de doubles-liaisons. On ne s’intéresse pas autres positions, puisque la progression se fait forcément de 3 en 3 (en biologie uniquement). Dans le cas de l’acide arachidonique, on va alors noter : 20 : 4 ω 6 (4 correspond au nombre de doubles-liaisons ; 6 correspond à la position de la première double-liaison) ;
Comment passer d’une nomenclature à l’autre ?
- C20, ∆5,8,11,14 ➔ ω : je note le nombre de carbone en premier ; puis le compte le nombre de doubles-liaisons ; je détermine la position de la première double-liaison en faisant : nb total de carbone – chiffre de la double-liaison la plus éloignée = 20 – 14 = 6. L’ensemble me donne 20 : 4 ω 6 ;
- 20 : 4 ω 6 ➔ Cn, ∆a,b,c,… : n est égal au premier chiffre de la nomenclature ω. a, b, c, d, …. est donné par le second chiffre de la nomenclature ω. La valeur des lettres a, b, c … est déterminé à partir de la double-liaison la plus éloignée : valeur de la dernière lettre = n – dernier chiffre de la nomenclature ω. Valeur lettre précédente = valeur lettre suivante – 3. On détermine : n = 20 ; nombre de doubles-liaisons = 4 (a, b, c et d) ; position de la dernière double-liaison = 20 -6 = 14 = d ; valeur de c = d – 3 = 11 ; valeur de b = c – 3 = 8 ; valeur de a = b – 3 = 5. L’ensemble nous donne donc : C20, ∆5,8,11,14.
Les principaux acides gras mono- et polydésaturés sont les suivants :
Note : la notation Z/E ou cis/trans
Les atomes autour d’une double-liaison peuvent adopter deux isoméries possibles :
- Cis ou Z ;
- Trans ou E.
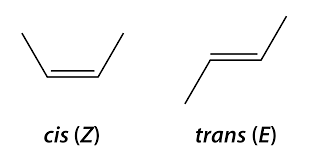
Dans les AG désaturés, la majorité des liaisons sont d’isomérie cis (voir documents 02 et 03). L’isomérie des doubles-liaisons n’est pas indiquée dans la nomenclature simplifiée, mais dans la terminologie IUPAC. Dans le cas de l’acide arachidonique, on obtient : l’acide (5Z, 8Z, 11Z, 14Z)-icosa-5,8,11,14-tétraénoïque.
I.D. Les dérivés de l’acide arachidonique = les eicosanoïdes
- Les eicosanoïdes sont des acides gras modifiés, dérivant de l’acide arachidonique ;
- Les eicosanoïdes existent essentiellement chez les animaux et quelques végétaux/bactéries ;
- Les eicosanoïdes sont répartis en plusieurs familles en fonction de leur structure :
| Modification de l’ac. arachidonique | Présence | Rôle | |
| Prostaglandines | Cyclooxygénase | Tous les tissus animaux | Pression sanguine, inflammation |
| Thromboxanes | Dérivés des prostaglandines | Plaquettes | Inhibition des prostaglandines |
| Leukotriènes | Lipooxygénase | Cellules sanguines | Respiration bronchique, perméabilité vasculaire, activation des leukocytes |
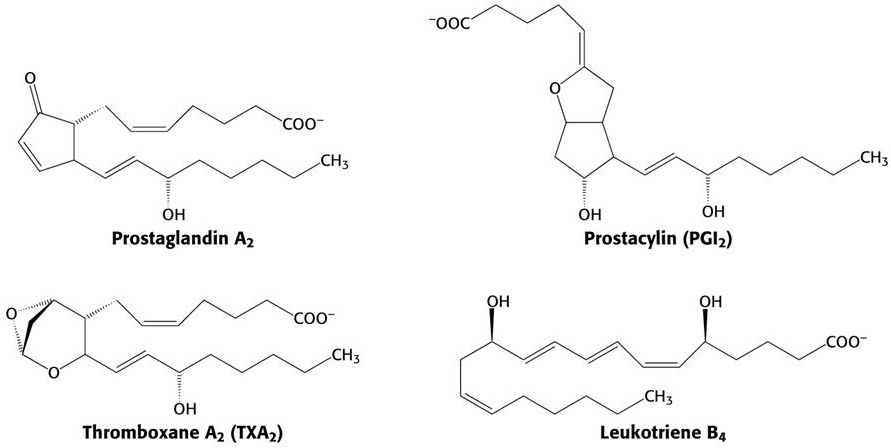
I.E. Autres acides gras (pour information)
- Les acides gras à très longue chaîne : 22 < n < 38. n paire ou non, ils sont saturés ou non, ramifiés ou non, hydroxylés ou non. Dans l’épiderme, il participe à l’élaboration de la barrière hydrofuge de la peau ;
- Autres altérations de la formule initiale des acides gras : fonction carboxylique remplacée par une fonction alcool ou aldéhyde…
II. Les glycérolipides
Comme cela est dit dans la partie 01, les AG sont rarement libres dans l’environnement, mais plutôt associés à d’autres molécules pour former des assemblages complexes. C’est le cas des glycérolipides : les AG sont attachés à une molécule, le glycérol (polyol).
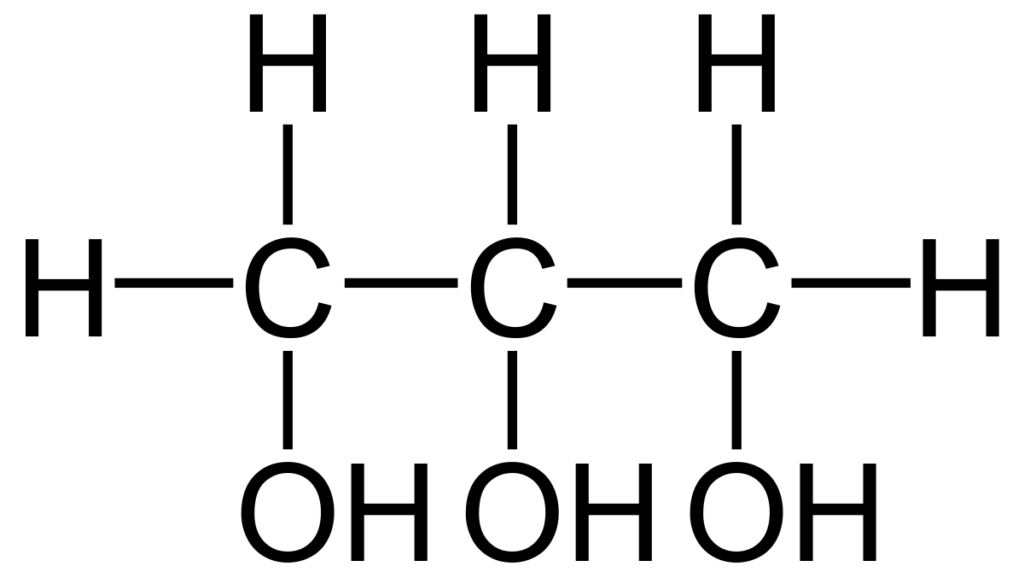
II.A. Les acyl-glycérols
- Assemblage simple d’AG et du glycérol ;
- Entre 1 et 3 AG peuvent être fixés sur le glycérol ;
- Les AG sont fixés par la formation d’une liaison ester entre la fonction acide de l’AG et la fonction alcool du glycérol ;
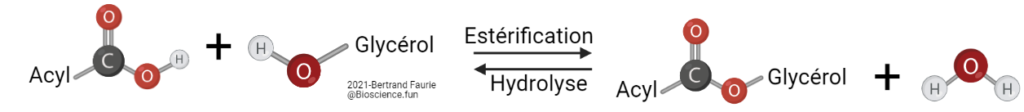
- Les AG fixés sur le glycérol peuvent être tous identiques ou différents ;
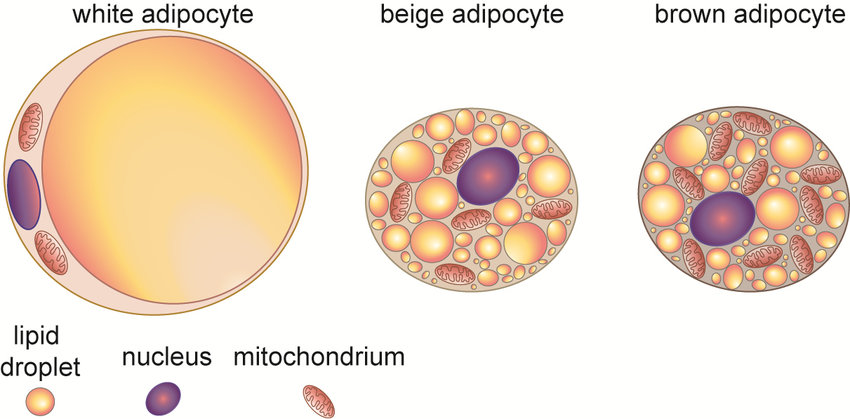
- Les acyl-glycérols ou triglycérides représentent la majeure partie des réserves énergétiques chez les animaux : soit à l’état libre dans le cytoplasme, soit sous forme d’inclusion. Les adipocytes, cellules spécialisées dans le stockage des triglycérides, contiennent une à plusieurs dizaines de vacuoles exclusivement constituées de triglycérides.
II.B. Les phospholipides
- Les phospholipides, ou glycérophospholipides ou phosphatides, sont une variation des acyls-glycérol ;
- On limitera l’étude aux diacylphosphatides, qui sont les plus fréquents en biologie. Mais il existe un grand nombre d’autres phosphatides, qui sont quasiment tous des dérivés des diacylphosphatides, avec des modifications plus ou moins importantes ;
- Le point de départ de la structure des diacylphosphatides est l’acide phosphatidique :
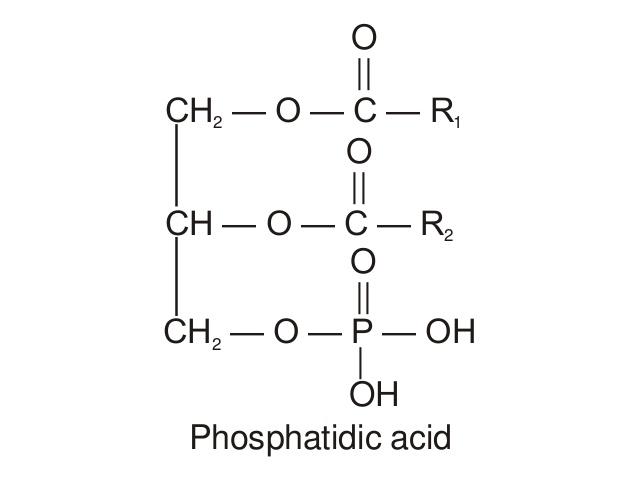
Dans ce cas, les deux premières positions d’estérification sont occupées par des acides gras, et la position 3 est estérifiée par un acide phosphorique (à la place de l’AG n°3).
- La diversité des diacylphosphatides provient de l’ajout d’une molécule supplémentaire par estérification d’une des fonctions hydroxyle libres de l’acide phosphorique.
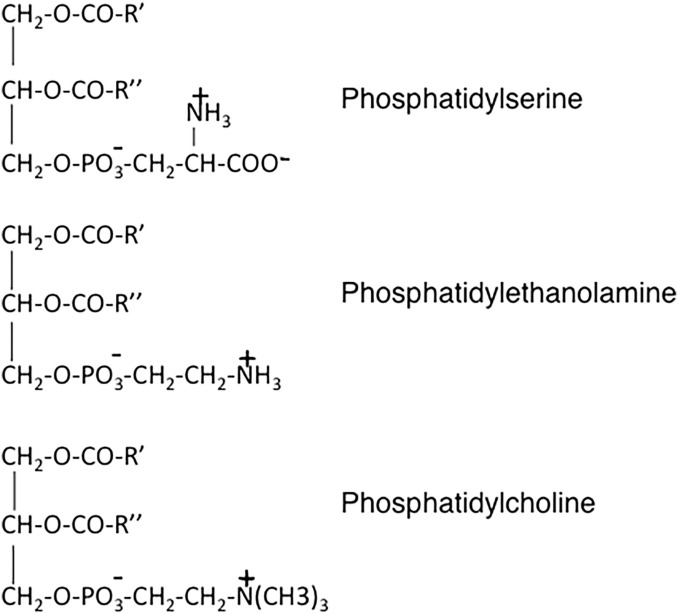
La phosphatidylcholine tient un rôle important dans l’industrie puisqu’il s’agit de la lécithine.
Note : les lécithines
- Il existe une grande diversité des lécithines, en fonction de la nature des AG qui occupent les positions 1 et 2 sur le glycérol. Cette diversité ne modifie pas les propriétés physiques de la lécithine ;
- Démontrer que la lécithine est amphiphile. Définir ce terme ;
- Démontrer que la lécithine est un zwiterrion. Définir ce terme ;
- L’équilibre hydrophile/lipophile (HLB) de la lécithine est compris entre 2 et 8, ce qui fait de cette molécule un émulsifiant globalement hydrophobe, adapté aux émulsions E/H (eau dans l’huile = dispersion d’eau dans une matrice grasse) ;
- Dans l’industrie, on utilise essentiellement la lécithine de soja.
| Origine | Synthèse | Rôle biologique | Utilisation industrielle |
| Humaine | Dans le foie | Emulsion des lipides de la digestion Structure des membranes plasmiques (25 %) Surfactant pulmonaire | X |
| Végétale | Toutes les cellules | Structure des membranes | E322i (intacte) E322ii (hydrolyse partielle) Amélioration de l’homogénéité des produits agroalimentaires |
III. Les sphingolipides
- Il s’agit d’un assemblage d’un AG sur un alcool, mais qui n’est plus le glycérol = la sphingosine ;
- L’assemblage AG-sphingosine n’est pas réalisé par une liaison ester mais une liaison amide = acide + amine (comme dans le cas de la liaison peptidique dans les protéines) ;
- Les sphingolipides sont des molécules assez massives, puisque de nombreux résidus osidiques peuvent s’ajouter à la structure ;
- On distingue alors : les sphingomyélines sans aucun ose ajouté ; les sphingoglycolipides avec oses ajoutés ;
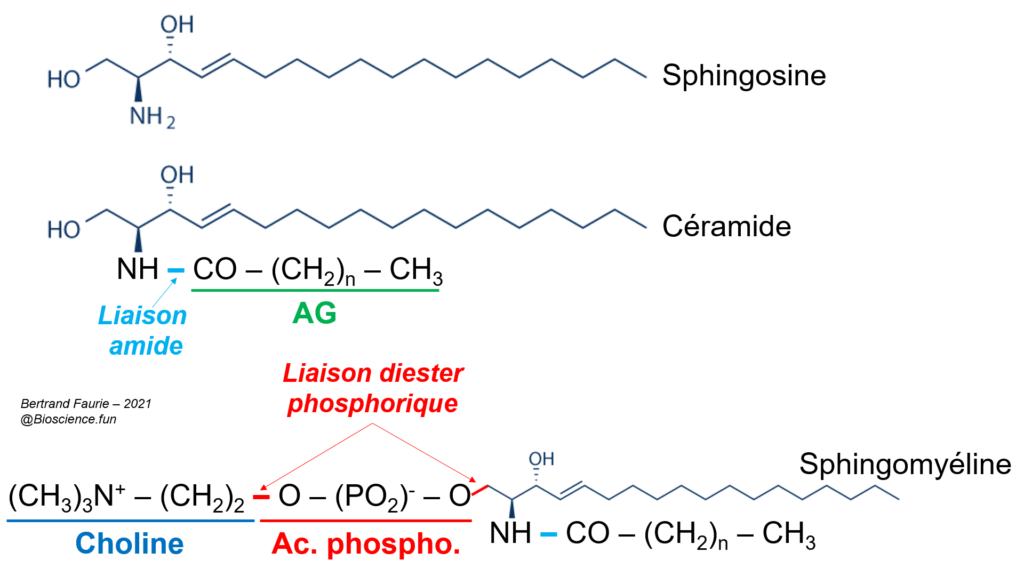
- Les sphingolipides sont des composants essentiels des membranes plasmiques, notamment au niveau des cellules nerveuses ;
- Certains sphingolipides sont exclusifs à un embranchement du vivant : les cérébrosides chez les vertébrés, ou les phytoglycolipides chez les plantes/champignons. D’autres sont présents dans tous les règnes, comme les glycolipides neutres.
IV. Les cérides
- Troisième forme d’assemblage entre un AG et un alcool (après les glycérolipides et les sphingolipides) ;
- Un AG est associé à un alcool à très longue chaîne :
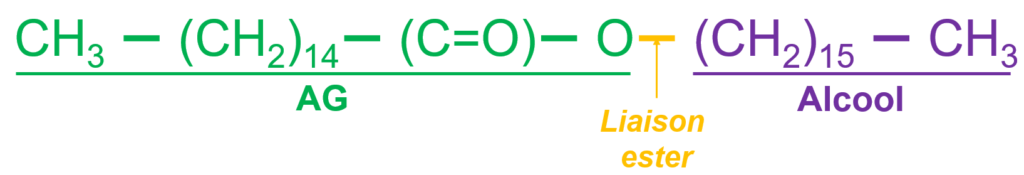
- Les cérides sont fortement hydrophobes ;
- Les cérides forment les cires végétales, cuticule des insectes, paroi de Mycobacterium tuberculosis, …
V. Les lipides polyisopréniques
- Changement radical dans la structure des lipides par rapport aux formes vues précédemment ;
- Construction en « polymère » par condensation d’une unité de base : l’isoprène ;
- Lipides à très longue chaîne particulièrement hydrophobes ;
- Rôles biologiques extrêmement variés ;
- Les lipides isopréniques sont omniprésents dans les règnes du vivant.
V.A. Synthèse des lipides isopréniques
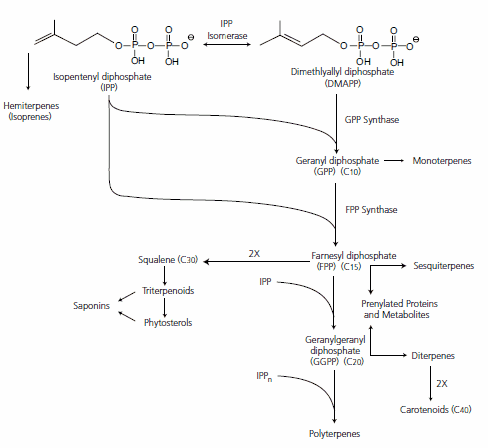
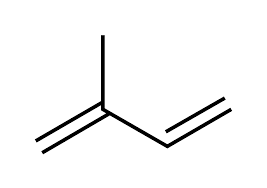
- Les lipides isopréniques sont des polymères d’isoprène (document 16). Mais cette molécule est peut réactive. Elle est polymérisée sous la forme d’IPP = isopenténylPP, associée au diméthylallylPP = DMAPP. Les pyrophosphates en font des molécules très réactives (synthèse explosives des caoutchouc en conditions industrielles) ;
- Deux voies permettent de fournir l’IPP et le DMAPP : la voie du mévalonate et la voie non-mévalonate. Ces deux voies sont issues de la glycolyse ;
- L’association IPP + DMAPP permet d’élaborer un géranyl-pyrophosphate en C10 ;
- Les autres molécules sont élaborées soit par ajout successif d’IPP (C5) soit par association entre elle : C15 + C15 = C30 (farnésyl PP + farnésyl PP) ;
V.B. Les monoterpènes
- Lipides isopréniques en C10 = géranylPP ;
- Linéaires, cycliques ou bicycliques ;
- Principaux composants des huiles essentielles végétales : camphre, géraniol, menthol, limonène ou citral.
V.C. Les sesquiterpènes
- Lipides isopréniques en C15 = farnésylPP = géranylPP + IPP
- Linéaires, cycliques, bicycliques ou tricycliques ;
- Autres composants des huiles essentielles végétales ou fongiques (moins répandus que les monoterpènes).
V.D. Les diterpènes
- Lipides isopréniques en C20 = géranylgéranylPP = géranylPP x 2 ;
- Linéaires, cycliques, bicycliques, tricycliques ou quadricycliques ;
- Rôles biologiques très variés : phytol (linéaire) ➔ vitamine K1 et E ; rétinol (monocyclique) = vitamine A ; taxanes (tricycliques) ➔ molécules thérapeutiques (taxol).
V.E. Les triterpènes
- Lipides isopréniques en C30 = farnésylfarnésylPP = farnésylPP x 2 ;
- Linéaires ou cycliques (1 à plusieurs cycles) ;
- Rôles biologiques très variés : squalène (linéaire) = physiologie des requins, cosmétiques, molécule thérapeutique, adjuvant vaccinal … ; stérols ; résines.
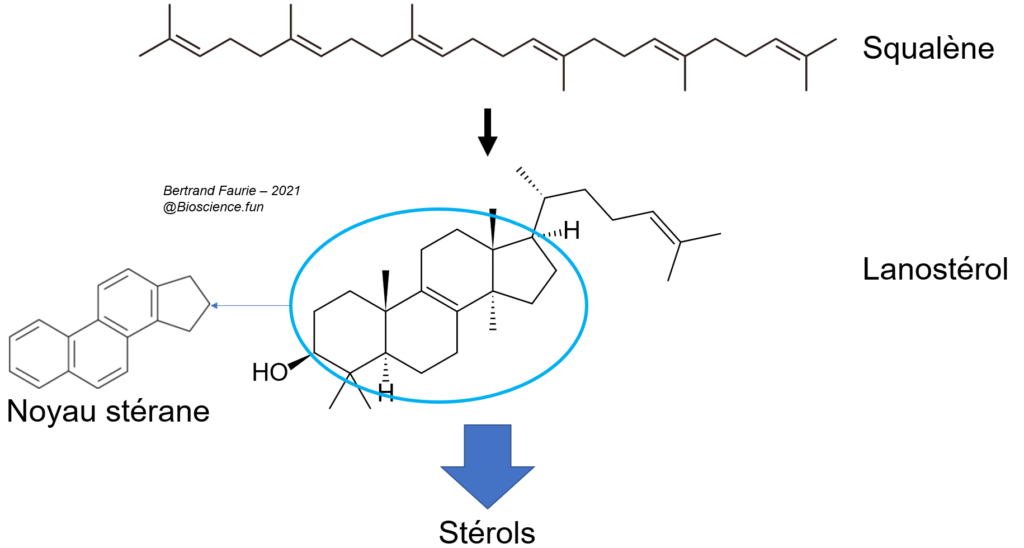
V.E.1. Les stérols et leurs dérivés
- Les stérols sont formés à partir du squalène : le premier stérol est le lanostérol ;
- Tous les stérols sont construits autour d’un noyau particulier : le noyau stérane (ou cyclopenthanophénentrène pour les intimes) ;
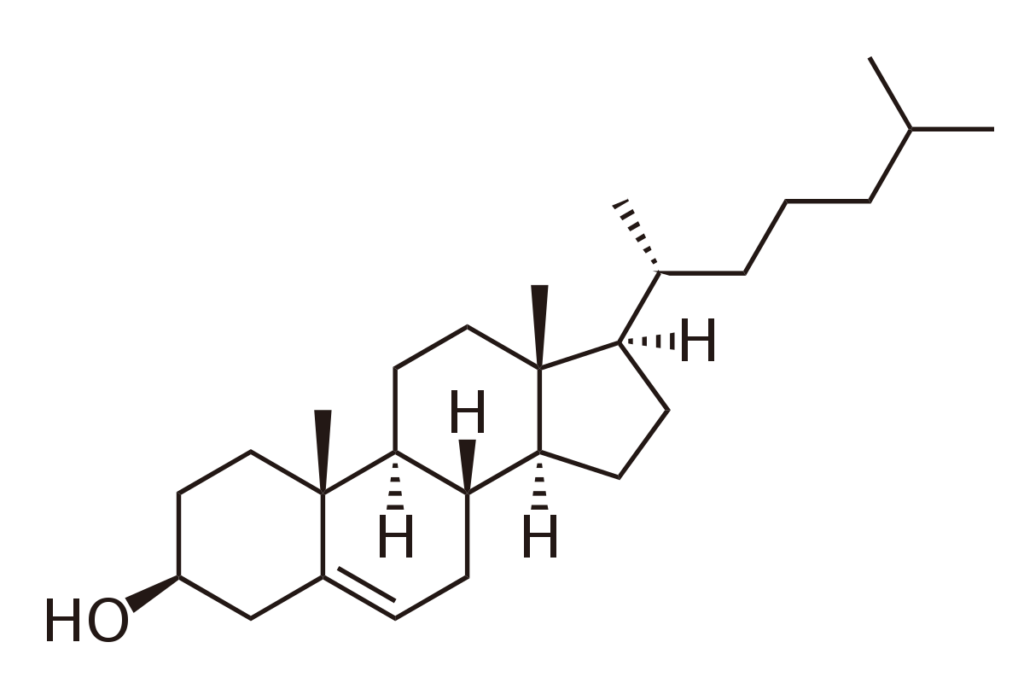
- Les principaux stérols sont : le cholestérol, l’ergostérol, le stigmastérol, …
- Les autres stérols sont des dérivés des précédents.
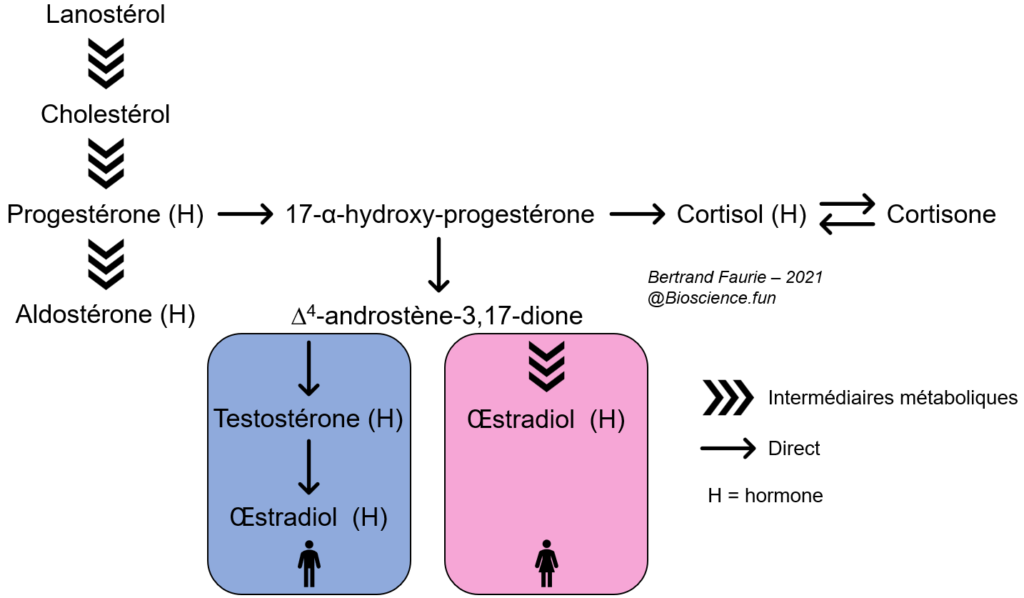
| Nom | Rôles biologiques |
| Aldostérone | Régulation de la volémie, régulation de la concentration en ions dans le sang |
| Cholestérol | Structure des membranes, circulation des lipides alimentaires |
| Cortisol | Régulation physiologique : immunité, veille/sommeil, métabolisme,… |
| Cortisone | Régulation du cortisol : forme inactive de cortisol |
| Œstradiol | Cycle féminin, édification de l’ovocyte, ovulation, caractères sexuels |
| Progestérone | Cycle féminin, procréation, maintien de l’embryon |
| Testostérone | Physiologie masculine, caractères sexuels |
- On trouve également dans les dérivés des stérols : la vitamine D2, l’ecdysone (régulation de la mue des insectes), les brassinoïdes (hormones végétales contrôlant notamment la sexualité des plantes), les alcaloïdes et hétérosides stéroïdiques (métabolites secondaires végétaux très nombreux, souvent toxiques, impliqués dans de nombreuses fonctions physiologiques…).
V.E.2. Les hopanoïdes
- Les bactéries ne peuvent pas synthétiser le cholestérol ;
- Certaines peuvent l’intégrer tel quel dans leur membrane, mais cela reste marginal ;
- Les bactéries synthétisent un stérol proche, basé sur une structure cyclique propre : le cycle hopane ;
- Les fonctions des hopanoïdes seraient analogues à celles des stérols.
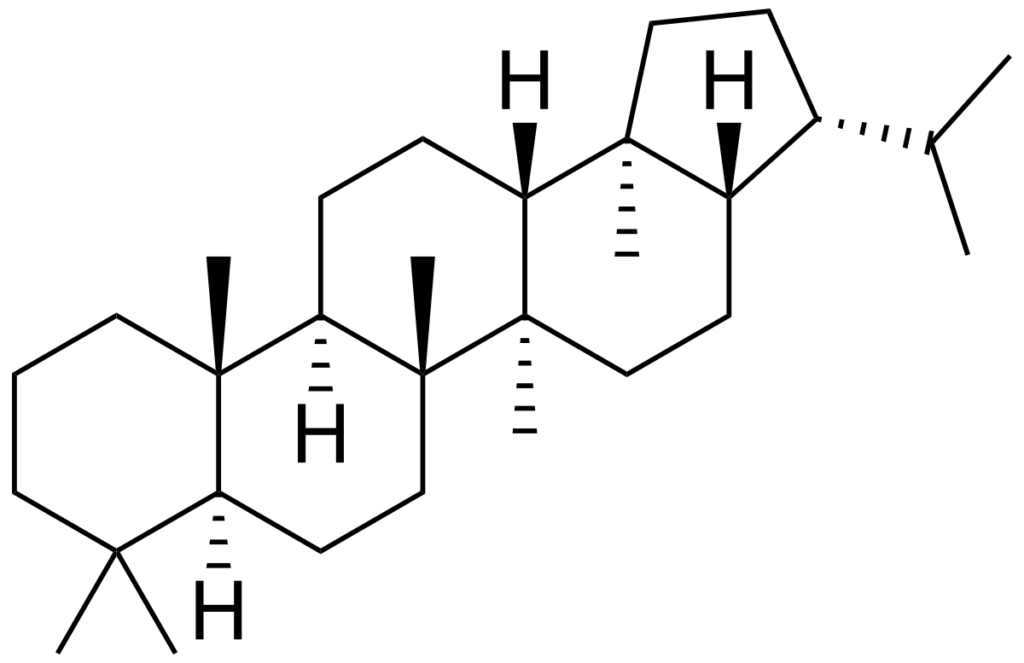
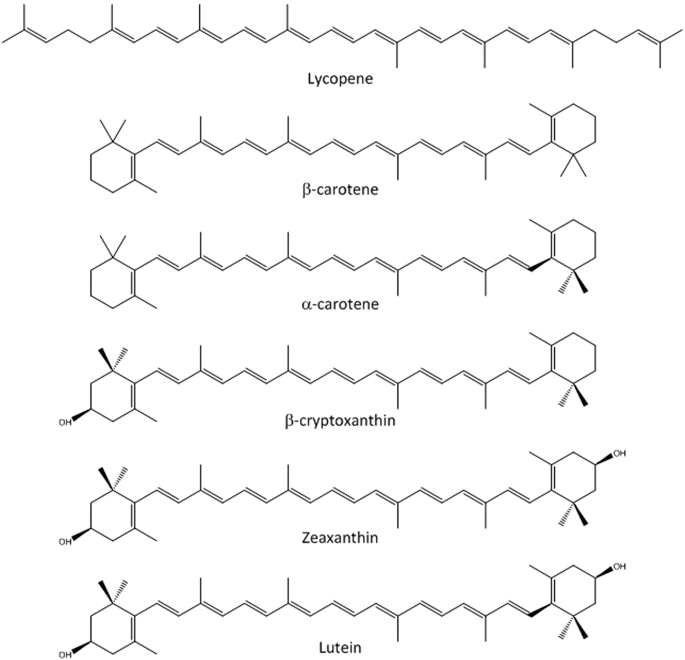
V.F. Les caroténoïdes
- Lipides isopréniques en C40 = géranylgéranylPP x 2 ;
- Linéaires à deux cycles aux extrémités (sauf lycopène, totalement linéaire) ;
- Rôles biologiques : pigments végétaux = carotènes et xanthophylles (carotènes hydroxylés).
- La vitamine A (rétinol) est obtenue par rupture centrale d’un carotène ou d’une xanthophylle. Le rétinol permet la fabrication du pigment de la rétine = la rhodopsine.
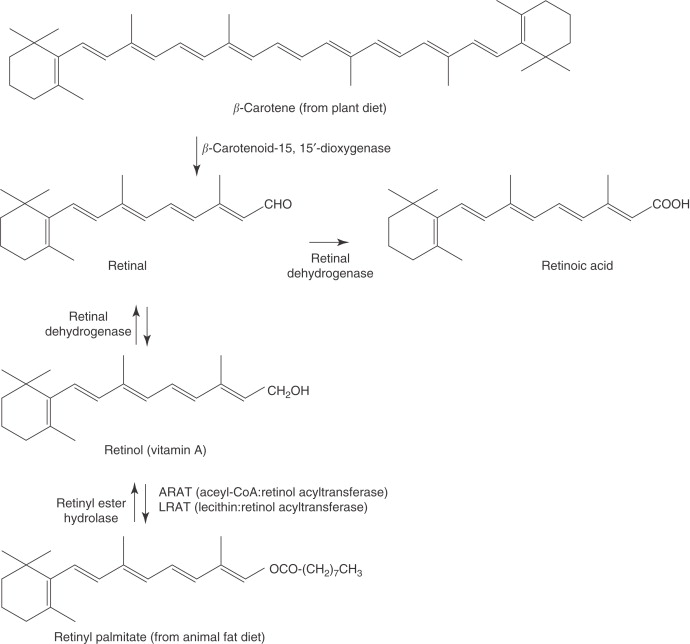
- L’acide rétinoïque a un rôle essentiel dans le développement embryonnaire = développement de l’axe antéro-postérieur du système nerveux ; position précise des membres ; formation de la rétine, du cervelet,… L’acide rétinoïque agit en contrôlant l’expression des gènes du développement Hox.
V.G. Les quinones polyisopréniques
- Les quinones sont des molécules existantes sous deux états : quinone (oxydée) et hydroquinone (réduite) ;
- Cette propriété est à la base de l’activité biologique de nombreuses quinones, comme les ubiquinone (coenzyme Q10) ou plastoquinone : chaîne respiratoire mitochondriale ou chloroplastique ;
- On trouve également dans les quinones les vitamines E et K ;
- Ces quinones possèdent une chaîne polyisoprénique plus ou moins importante : 3 résidus pour le tocophérol et 10 résidus pour les ubiquinones. Ces chaînes isopréniques très longues permettent notamment l’enchâssement dans les membranes biologiques.
VI. Contrôle de la fluidité membranaire
- Les cellules ainsi que les structures artificielles comme les liposomes sont délimitées par une double-membrane lipidique ;
- Cette membrane contrôle les échanges entre l’intérieur et l’extérieur ;
- La fluidité de la membrane est donc un élément essentiel dans le rôle de « tamisage » des produits circulant entre les deux espaces.
Cette membrane frontière sont un empilement de deux couches de lipides = double-membrane lipidique.
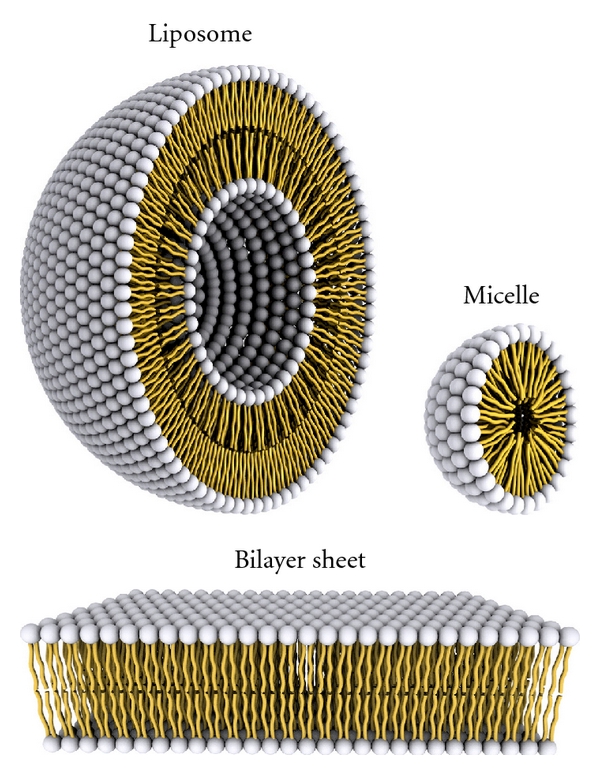
- La fraction lipidique de ces membranes est principalement composée de phosphatides et de cholestérol ;
- La nature des phosphatides et la proportion de cholestérol va modifier la fluidité membranaire.
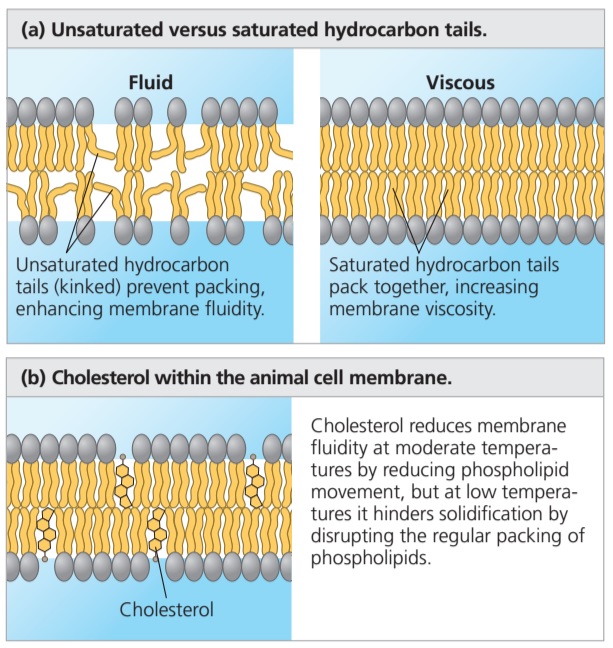
- Les phosphatides à base d’AG saturés (chaîne aliphatique droite) forment une couche compacte, peu mobile = structure visqueuse ;
- Les phosphatides à base d’AG désaturés (chaîne aliphatique courbée par les doubles-liaisons -cis) s’éloignent les uns des autres. Il en résulte un assouplissement de la structure de la membrane qui devient plus fluide ;
- Le cholestérol joue à deux niveau = il réduit la fluidité de la membrane en limitant le déplacement des phosphatides (107 mouvements/sec en moyenne). Mais il réduit aussi les capacités de figeage de la membrane à basses -températures et donc réduit sa viscosité.
Applications !
- Propriétés morphologiques et mécaniques des biomembranes artificielles.
- Introduction à la chromatographie par liposomes immobilisés (ILC) = étude de la capacité des molécules à traverser une membrane (médicaments). Effets de la composition des liposomes employés pour l’ILC.
- Détermination de la meilleure formulation liposomale pour la délivrance d’un antifongique par voie cutanée.
- Utilisation des liposomes pour développer un modèle de cellules olfactives et étude de l’impact de la composition de la membrane sur la perception des odeurs. Article.
Exercices
Fin du chapitre 01
