I. Définition
Les coenzymes (ou cofacteurs, surtout en anglais) sont des éléments qui participent au fonctionnement catalytique normal des enzymes. De façon générale, les coenzymes sont des molécules de faible masse moléculaire, non-protéiques, associées de façon plus ou moins directe à la protéine.
On peut distinguer deux types de coenzymes :
- Les coenzymes fixes (ou vrais) : ils font partie intégrante de l’enzyme (ce sont des groupements prosthétiques). Ils sont généralement fixés de façon covalente aux acides aminés de la protéine. Ils sont proches ou inclus dans le site actif de l’enzyme : ils sont parfois responsables de l’activité catalytique de l’enzyme, la partie protéique constituant uniquement un châssis. Ces cofacteurs n’apparaissent pas dans l’équation de la réaction, car ils sont inclus dans l’enzyme ;

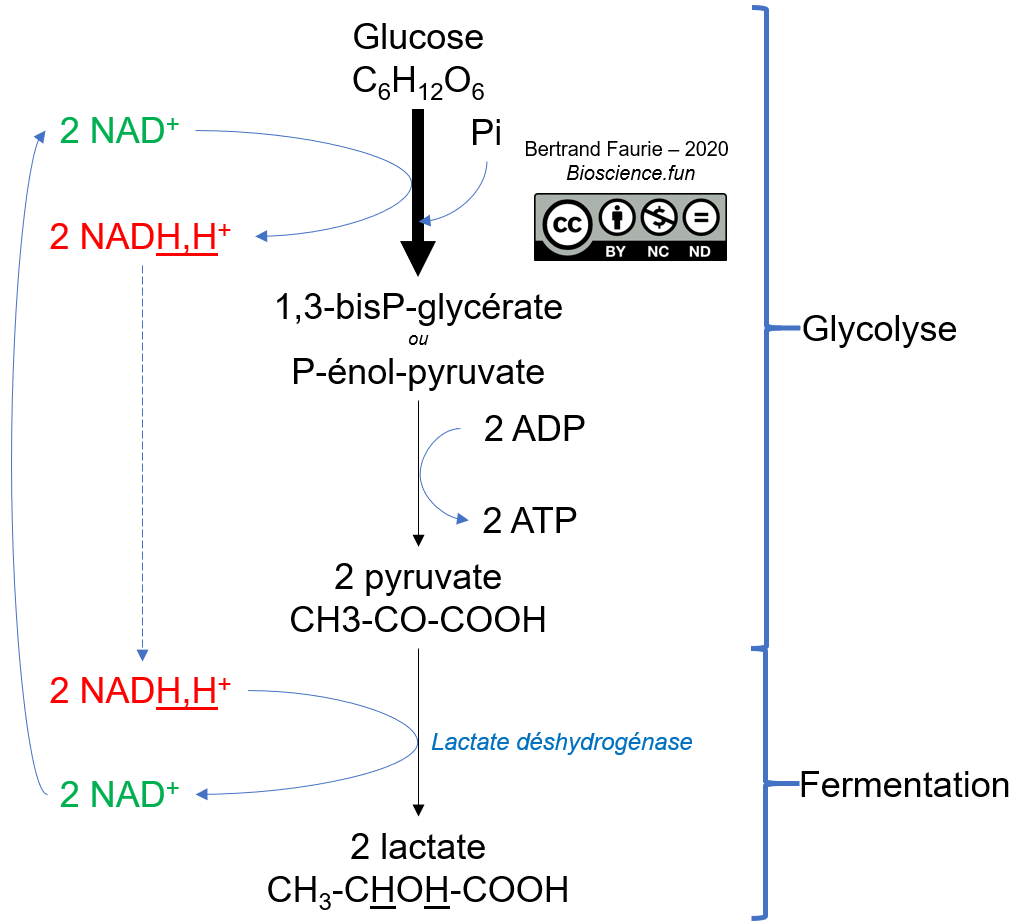
- Les coenzymes mobiles : ils ne sont pas liés durablement à l’enzyme mais agissent comme un co-substrat de l’enzyme et apparaissent généralement dans l’équation chimique (sur la flèche). Exemple : Le NAD+ et l’ADP sont des cofacteurs nécessaires au bon fonctionnement des enzymes de la glycolyse.
Note : de très nombreuses enzymes nécessitent également des ions métalliques, comme le Mg2+ ou le Zn2+. On parle alors de métallo-enzyme. Ces ions ne sont pas considérés comme des coenzymes, mais restent toutefois nécessaires au bon fonctionnement de l’enzyme. Par exemple, la majorité des enzymes utilisant de l’ATP possèdent des ions Mg2+ qui permettent de neutraliser les très nombreuses charges négatives des phosphates de l’ATP.
Au cours du processus catalytique, le coenzyme est structurellement modifié. Pour qu’une nouvelle réaction enzymatique puisse avoir lieu, il faut que le coenzyme retrouve sa structure initiale : ce processus est le cycle des coenzymes. Son déroulement dépend du type de coenzyme mobilisé :
- Coenzyme vrai : sa structure étant liée à l’enzyme, il doit être régénéré in situ, sans quoi l’enzyme cesse de fonctionner. Dans ce cas, la réaction enzymatique est divisée en plusieurs étapes : dans un premier temps, modification du coenzyme à des fins catalytiques, puis dans les étapes suivantes, régénération du coenzyme ;
- Coenzyme mobile : il peut se déplacer dans l’environnement cellulaire pour être pris en charge par une autre enzyme qui va le régénérer. Comme la quantité de coenzyme mobile est limitée dans la cellule, cette étape de régénération doit être très fréquente et efficace !
Il existe plusieurs classifications des coenzymes, soit en prenant en compte leur « attachement à l’enzyme », soit en prenant en compte leur rôle dans la réaction enzymatique. C’est cette classification que nous avons choisi de présenter.
II. Les coenzymes d’oxydoréduction
Rappel : principe d’une équation d’oxydoréduction
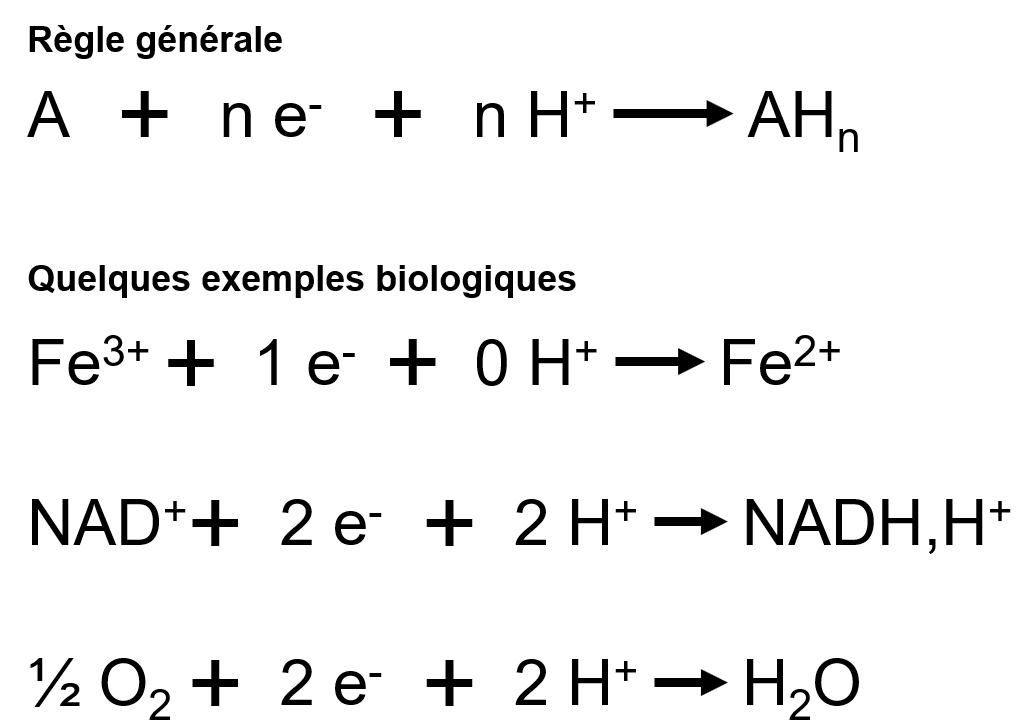
Au cours d’une réaction d’oxydoréduction, l’enzyme peut provoquer :
- L’arrachage d’électrons du substrat : les électrons doivent alors être pris en charge par une nouvelle molécule pour ne pas se balader dans le cytoplasme/matrice/stroma. Ce qui pourrait être dangereux pour les autres molécules environnantes ;
- L’ajout d’électrons au substrat : les électrons sont pris à une molécule (substrat ou co-substrat) et donnés à une autre (substrat).
Dans les voies métaboliques, la plupart du temps (exception faites du cycle de Calvin et la biosynthèse des lipides), il s’agit quasiment toujours de l’arrachage d’électrons d’un substrat (oxydation comme la glycolyse) et leur prise en charge par un coenzyme mobile d’oxydoréduction.
A. Les couples NAD+/NADH,H+ et NADP+/NADPH,H+
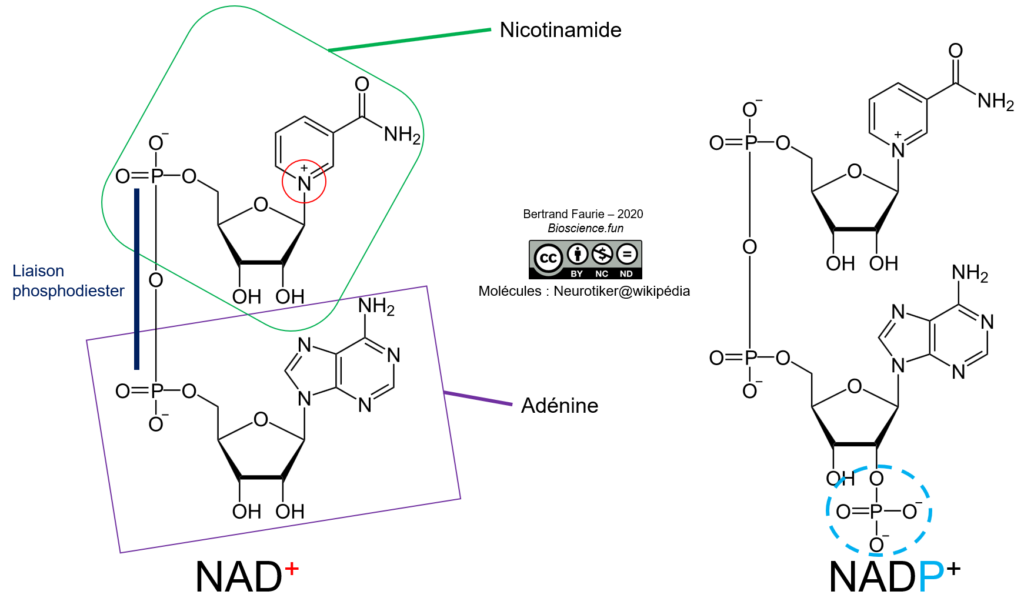
Le nicotinamide-adénine-dinucléotide est une association de deux bases : l’adénine monoP et le nicotinamide monoP, réunies par une liaison phosphodiester. Le NAD peut exister sous deux formes :
- Le NAD : nicotinamide-adénine-dinucléotide ;
- Le NADP : nicotinamide-adénine-dinucléotide phosphate. Un phosphate est ajouté en position 2′ sur le ribose de l’adénine monoP.
Les deux formes constituent des couples d’oxydoréduction, définis par la demi-équation suivante :
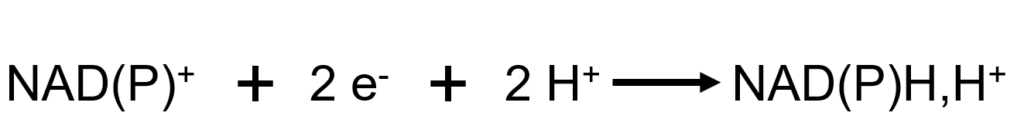
La notation NAD(P)H,H+ (proton séparé par une virgule) est liée au fait qu’au cours de la réaction de réduction du NAD(P)+, un seul proton est pris en charge sur la molécule pour deux électrons :
- Un des électrons permet de modifier la conformation des doubles-liaisons du cycle aminé du nicotinamide. Il nécessite un proton pour être stabilisé ;
- L’autre électron va combler la charge manquante sur le N+ du cycle. Il ne nécessite donc pas de proton complémentaire pour être stabilisé ! Le proton est libéré dans le milieu, ce qui contribue à son acidification.

Mobilité : très importante, mais ils ne peuvent pas franchir l’enveloppe mitochondriale sous forme réduite ! Ce sont donc des coenzymes mobiles !
Utilisation : le NAD+ est mobilisé dans quasiment toutes les réactions d’oxydation du métabolisme, en tant qu’accepteur des électrons (oxydant). Le NADP+ est lui plutôt utilisé comme donneur d’électron (réducteur).
Régénération : étant donné le rôle central du NAD(P) dans le métabolisme oxydatif, il faut mettre en place un mécanisme tout aussi central, pour pouvoir le régénérer. C’est donc la principale fonction de la respiration (O2 ou autre) et des fermentations (ces processus seront vus en détail dans le module 03).
Remarque : le NAD possède des propriétés spectrales qui dépendent de son état d’oxydoréduction, ce qui peut être exploité au laboratoire.
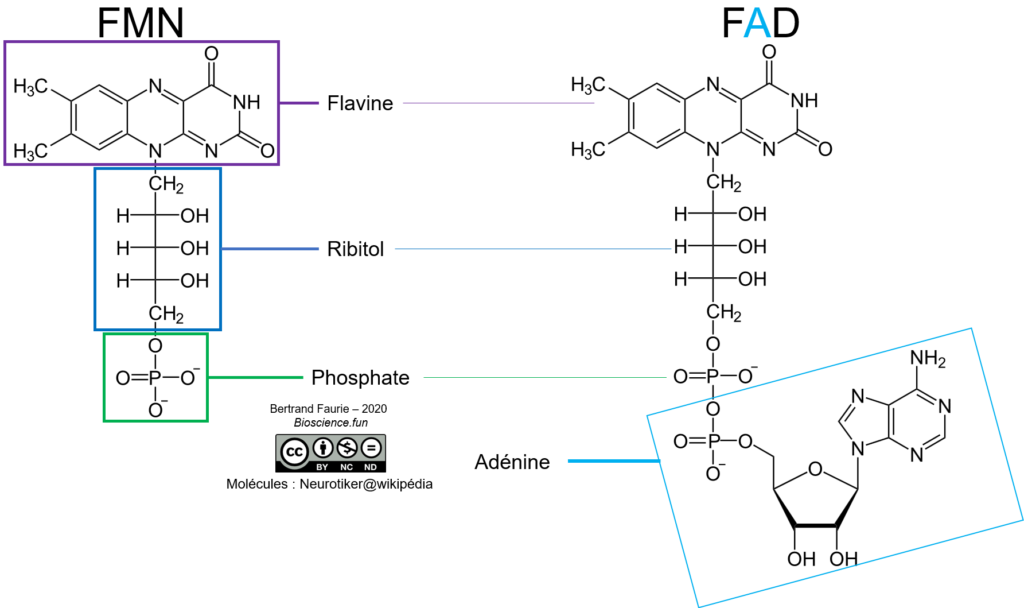
B. Les couples FMN/FMNH2 et FAD/FADH2
De la même façon que pour le NAD(P), le FMN et FAD sont des dérivés de bases azotées, très proches l’un de l’autre :
- FMN : flavine mono-nucléotide (pseudo-base azotée en raison du remplacement du ribose par du ribitol = pas de sucre en conformation cyclique) ;
- FAD : flavine-adénine-dinucléotide = association de la FMN à une adénine monoP par une liaison phosphodiester.
Les deux formes constituent des couples d’oxydoréduction, définis par les demi-équations suivantes :
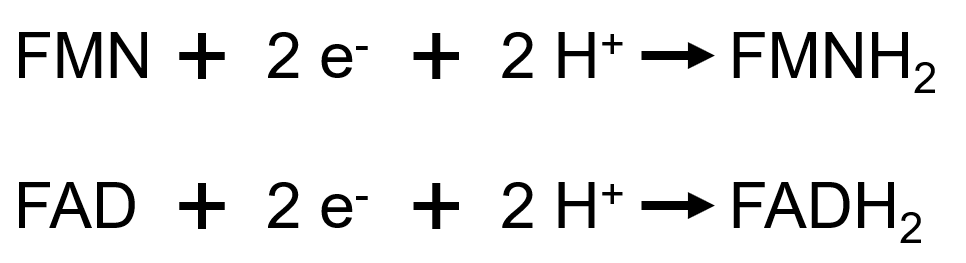
Dans ce cas, et à la différence du NAD(P), tous les protons se fixent sur la molécule au cours du processus de réduction. La notation sera bien : FXX/FXXH2
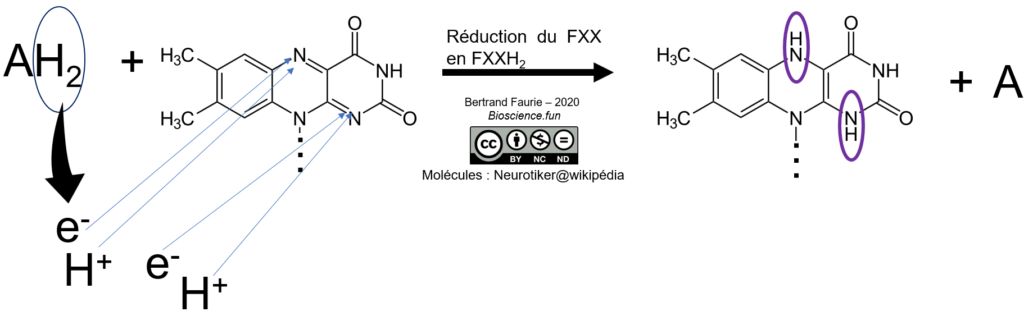
Mobilité : nulle. FMN et FAD sont fermement fixés à leur enzyme. Ce sont des coenzymes vrais !
Utilisation : FMN et FAD sont associés à des réactions d’oxydation (ils sont accepteurs d’électrons) du métabolisme comme la dégradation des lipides, le cycle de Krebs, les navettes mitochondriales, …
Régénération : comme il s’agit de groupements prosthétiques (rappel : groupement fixé de façon covalente à la protéine), ils doivent être régénérés au cours de la réaction enzymatique, en faisant intervenir un oxydant mobile, comme le NAD+ ou un acide organique (couple malate/aspartate, …).
Remarque : les flavines sont des pigments dont l’allure du spectre d’absorption peut changer avec l’état oxydé ou réduit. Comme pour le NAD, cette propriété peut être exploitée au laboratoire.
C. Les ferroporphyrines
Les ferroporphyrines sont des groupements prosthétiques complexes, utilisant le couple Fe3+/Fe2+ pour sa propriété oxydoréductive.
Demi-équation du couple :

Mobilité : nulle. C’est un groupement prosthétique ;
Utilisation : les ferroporphyrines interviennent notamment dans le transport du dioxygène (hémoglobine) et dans les cytochromes des chaînes respiratoires (voir module 03) ;
Régénération : dans le cas des cytochromes, il s’agit d’une cascade de réactions d’oxydoréduction (le cytochrome réduit en position n est oxydé par le cytochrome en position n+1), qui aboutissent à la cession d’électrons au dioxygène pour former de l’eau (voir module 03). Le fer de l’hémoglobine n’est pas oxydé/réduit pour fixer le dioxygène.
Note : le fer de l’hémoglobine est à l’état Fe2+ (forme réduite). Sous l’effet de poisons, il peut passer sous forme Fe3+ (forme oxydée) mais dans ce cas, l’hémoglobine ne peut plus fixer le dioxygène…
d. L’acide lipoïque
Il s’agit d’un groupement prosthétique, associé notamment à la pyruvate déshydrogénase. Il forme le couple oxydoréducteur suivant : lipoate/déhydrolipoate. Il est régénéré en cours de réaction par association avec un autre coenzyme oxydoréducteur (fixe ou mobile).
III. Les coenzymes de transfert de groupements
Dans ce cas, les coenzymes ne participent plus à des réactions d’oxydoréductions, mais permettent le déplacement de groupements chimiques (ajout ou retrait) sur une molécule. Il existe des coenzymes de transfert de groupements (CoETG) qui sont mobiles et d’autres qui sont fixes.
a. Le coenzyme A

La structure du coenzyme A rappel fortement celle de l’ATP avec :
- Une adénine ;
- Un ribose mais phospho-estérifié sur le sucre en 3′ ;
- Un enchaînement d’acides phosphoriques (2).
Le coenzyme A contient également un pantothénate et un acide aminé, la cystéine. C’est la chaîne latérale de la cystéine qui est responsable de l’activité du coenzyme A. En effet, elle se termine par une fonction thiol (-SH) très réactive , qui permettra de fixer le coenzyme A sur des résidus acyls plus ou moins longs. Les résidus acyls sont liés au coenzyme A par une liaison thio-ester très énergétique = elle libère beaucoup d’énergie quand on la casse (on parle de liaison à haut potentiel de transfert).
Mobilité : le coenzyme A est très mobile, et peut se déplacer d’une molécule à l’autre, ce qui lui permet notamment de se régénérer.
Utilisation : le coenzyme A permet de transférer des groupements acyles (élimination de groupe hydroxyle à une fonction carboxyle) à une molécule. Ceci permet d’allonger une molécule d’autant d’atomes de carbone qu’il y en a après liaison thio-ester. Ce mécanisme est essentiel pour la biosynthèse des lipides, le cycle de Krebs, …
Cet ajout de carbones demande beaucoup d’énergie qui est apportée par la rupture de la liaison thio-ester entre l’acyl et le coenzyme A (couplage énergétique chimio-chimique, voir module 03).
Régénération : le coenzyme A est faiblement altéré par son fonctionnement. L’acyl-CoA se scinde facilement en acyl (fixé sur une molécule tierce) et en coenzyme A qui est alors régénéré.
b. Faire bouger le CO2 : TPP et biotine
Le résidu carboxyle (CO2) est souvent déplacé d’une molécule à une autre, notamment pour ajouter un carbone à une molécule. Cette opération est prise en charge par deux coenzymes, tous les deux fermement liés à leur enzyme (groupements prosthétiques). Ces groupements sont donc régénérés au cours d’une étape de la réaction de transfert.
- TPP : thiamine pyro-phosphate. C’est le coenzyme de décarboxylation, il permet d’éliminer un CO2 d’un substrat. Exemple : décarboxylation du pyruvate en acétate par la pyruvate déshydrogénase (étape préliminaire du cycle de Krebs) ;
- Biotine : c’est le coenzyme de carboxylation, il permet de fixer un CO2 sur un substrat. Exemple : carboxylation de l’acétylCoA en malonylCoA par l’acétylCoA carboxylase (biosynthèse des lipides).
c. Faire bouger un C1
Dans certains cas, il suffit de déplacer un seul atome de carbone sur un substrat pour obtenir le produit souhaité. Deux coenzymes mobiles sont impliqués dans ce type de réaction enzymatique :
- L’acide tétrahydrofolique : synthèse de bases azotées, conversion d’acides aminés ;
- La S-adénosyl-méthionine : elle permet le transfert spécifique d’un résidu méthyle (-CH3), notamment pour la synthèse de la créatine, ou la méthylation des ARNs
d. Faire bouger du phosphate
Le déplacement du phosphate est nécessaire notamment dans les processus métaboliques nécessitant de l’énergie (rupture d’une liaison à haut potentiel de transfert) et dans la régulation enzymatique.
Ce déplacement est réalisé essentiellement par l’ATP : adénosine triphosphate. La molécule sera vue en détail dans le module 03.
IV. Le cas de la pyruvate déshydrogénase
Voici la réaction catalysée par la pyruvate déshydrogénase :
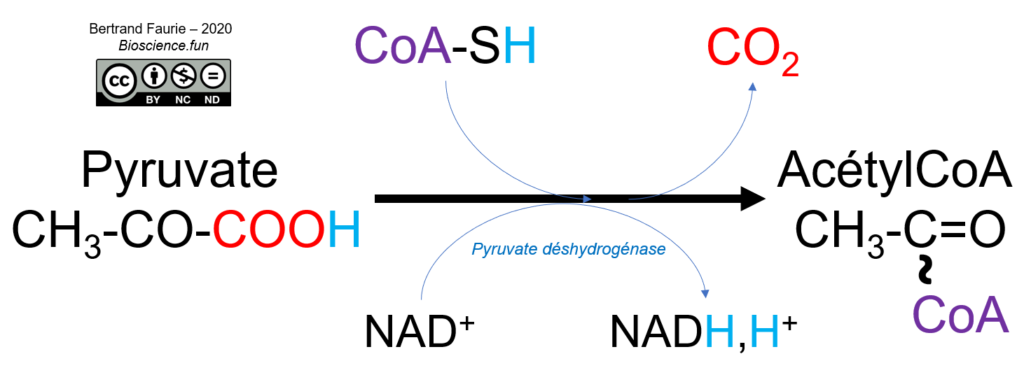
La pyruvate déshydrogénase est un complexe de trois enzymes qui mobilisent 3 coenzymes fixes (TPP, lipoate et FAD) et 2 coenzymes mobiles (CoA et NAD+) :
- E1, associée à la thiamine pyrophosphate : elle est responsable de la décarboxylation du pyruvate en acétaldéhyde. La fixation du pyruvate sur la thiamine PP provoque sa décarboxylation ;
- E2, associée à l’acide lipoïque oxydé : l’acétaldéhyde est oxydé par réduction de l’acide lipoïque, ce qui provoque sa fixation covalente sur l’enzyme. Un autre site de fixation est alors libéré pour permettre la fixation du coenzyme A. Les deux substrats sont fixés à l’enzyme jusqu’à leur combinaison, ce qui les libère de l’enzyme ;
- E3, associée au FAD : elle permet la ré-oxydation de l’acide lipoïque de E2 par formation de FADH2 ;
Et le NAD+ dans tout ça ? Il permet de ré-oxyder le FADH2 de E3 qui a permis de ré-oxyder l’acide lipoïque de E2. Le coenzyme A est fixé sur l’acétyl formé par décarboxylation du pyruvate.
La décarboxylation du pyruvate est donc associée à une oxydation = décarboxylation oxydative.
V. Coenzymes et vitamines
Les coenzymes sont très souvent des dérivées de vitamines (molécules non-produites par l’organisme et uniquement apportées par l’alimentation). C’est notamment le groupe B, des vitamines hydrosolubles, qui fournissent la majeure partie des coenzymes.
| Coenzyme | Origine |
| NAD(P)+ | Vitamine PP |
| Flavine-nucléotides (FMN et FAD) | Riboflavine (B2) |
| TPP | Thiamine (B1) |
| Coenzyme A | Acide pantothénique (B5) |
| Acide tétrahydrofolique | Acide folique (B11) |
| Phosphate de pyridoxal | Pyridoxine (B6) |
