Introduction
Science qui étudie les enzymes, leur réactivité et leurs régulations dans le but de les exploiter pour les Biotechnologies
L’enzymologie s’est développée dans toutes les couleurs des Biotechnologies
Les enzymes, placées dans des conditions optimales de fonctionnement, sont capables de réaliser toutes les réactions du vivant…
Les conditions de fonctionnement des enzymes
Utilisation directe d’un organisme possédant naturellement l’enzyme, pour réaliser un processus biotechnologique
Mise en culture d’un tissu, prélevé sur un organisme possédant naturellement l’enzyme, pour réaliser un processus biotechnologique
Purification de l’enzyme, et reproduction de son environnement de « travail » dans un tube à essai, pour réaliser un processus biotechnologique
I. La réaction enzymatique
Une enzyme est un catalyseur = elle accélère les réactions chimiques
Voir tableau suivant

II. Formalisme de la réaction enzymatique
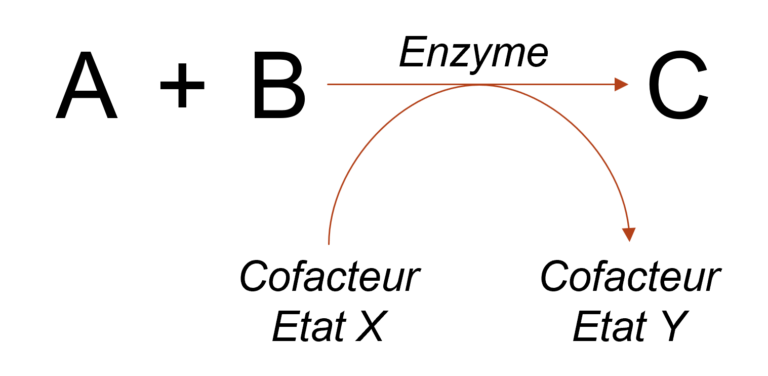
- A et B sont des réactifs = on parle de substrats de l’enzyme
- C est le produit de la réaction enzymatique
- A et B sont combinés en C
- L’enzyme accélère la combinaison de A et B en C
- L’enzyme n’est pas consommée, modifiée, altérée… Elle est intacte à la fin de la réaction. Elle peut subir des modifications transitoires (quelques nanosecondes) au cours du processus
- L’enzyme enchaîne les réactions tant que des substrats sont disponibles
Le cofacteur aide la réaction enzymatique, en acceptant notamment des électrons. Il est recyclé par les processus cellulaires de respiration ou fermentation.
III. Nature chimique des protéines
- Les enzymes sont des protéines, composées d’acides aminés
- Les enzymes peuvent également contenir des éléments non-protéiques, appelés groupements prosthétiques
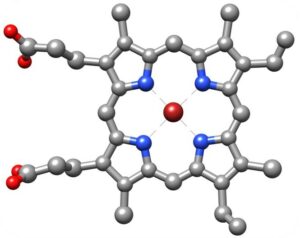
- Les enzymes contiennent très souvent des ions qui participent à la réaction de catalyse : Mg2+, Zn2+, Mn2+ ou Fe2+. Ces ions sont apportés par l’alimentation (sels minéraux)
- Des cofacteurs aident les enzymes à réaliser la réaction de catalyse. Ils sont mobiles OU associés physiquement à l’enzyme
La structure des protéines
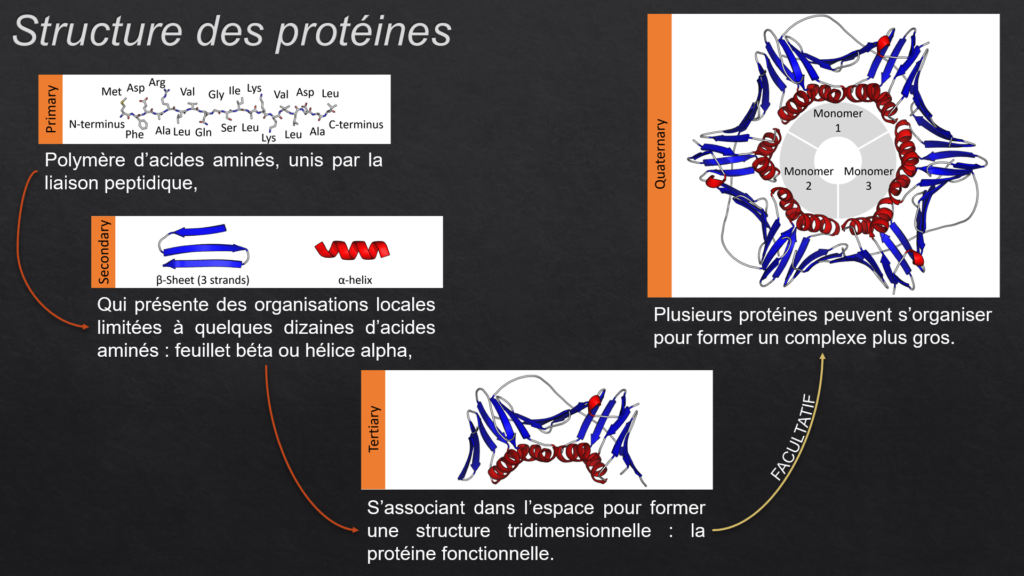
Assemblage linéaire d’acides aminés
Apparition de formations locales dans la chaîne d’acides aminés : hélices α ou feuillets β
Organisation 3D de la chaîne d’acides aminés, stabilisée par des ponts disulfures ou des interactions faibles
Assemblage de plusieurs structures tertiaires entre elles, identiques ou non
Structure protéique d'une enzyme
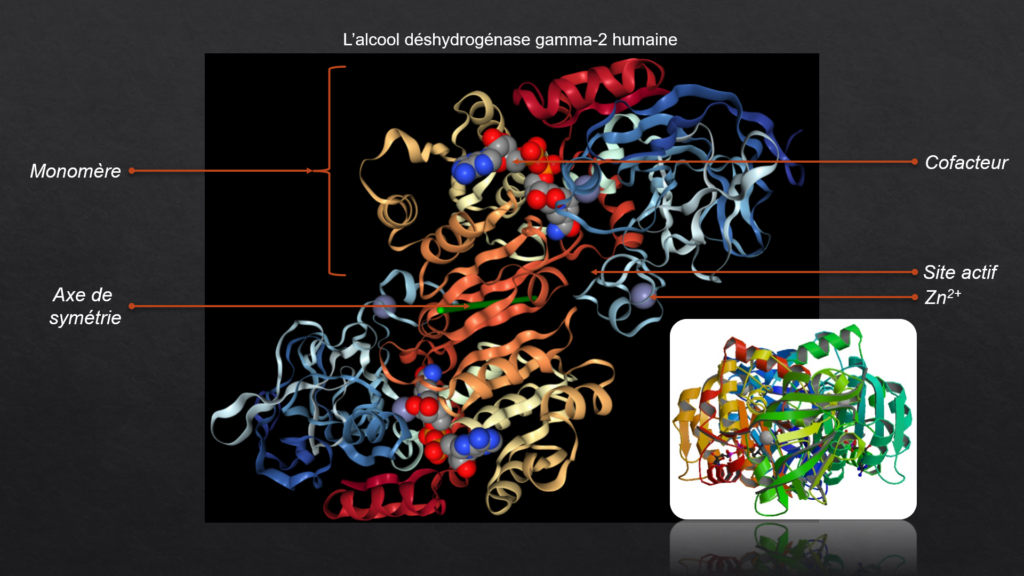
IV. Le site actif
- Le site catalytique est le cœur réactionnel de l’enzyme. C’est là que se déroule la réaction de catalyse
- Il est divisé en deux entités : le site de fixation du substrat et le site catalytique
- Le site actif forme une cavité. Cette cavité est structurée par le repliement 3D de la protéine
IV. A. Le site de fixation du substrat
- Sa forme dans l’espace définit la nature du substrat qui peut se fixer : une molécule ou une famille de molécules proches structurellement = spécificité de substrat
- Une enzyme a généralement plus d’affinité pour les substrats (qui se fixent facilement) que pour les produits (qui se décrochent facilement)
- Le site de fixation du substrat se trouve à proximité du site catalytique
IV. B. Le site catalytique
- Le site catalytique est responsable de la réactivité chimique de l’enzyme
- Il se trouve au contact du site de fixation du substrat
- Le site catalytique inclut également les cofacteurs fixes, les ions et les groupements prosthétiques, qui participent à la réaction
- Le cœur du site catalytique est formé par les chaînes latérales des acides aminés, qui font saillie dans la cavité réactionnelle
- L’interaction entre le substrat et l’ensemble des composants du site catalytique provoque la réaction chimique de transformation du substrat en produit
- L’organisation structurale du site catalytique ne permet la réalisation que d’un seul type de réaction chimique = spécificité de réaction
V. Comment étudier les enzymes au laboratoire ?
- L’activité d’une enzyme est suivie indirectement :
- Par suivi de la disparition du substrat
- Par suivi de l’apparition du produit
- Par suivi de la transformation d’un cofacteur
- Pour chaque réaction enzymatique, on va essayer de détecter l’un des composants de la réaction chimique
- On utilise des techniques de base de la biochimie : spectrophotométrie, chromatographie, …
- On définit pour chaque réaction enzymatique un système rapporteur :
Substrat et produit indétectables. On fournit à l’enzyme un chromogène (ONPG), substrat de substitution, qui devient coloré lorsqu’il es transformé en produit (ONP). On suit l’apparition d’une coloration jaune à 420 nm
Substrat et produit indétectables. On fournit à l’enzyme un chromogène (pNPP), substrat de substitution, qui devient coloré lorsqu’il es transformé en produit (pNP). On suit l’apparition d’une coloration jaune à 410 nm
Substrat et produit indétectables. Mais transformation d’un cofacteur au cours de la réaction (NADH → NAD+). Le NADH absorbe à 450 nm, mais pas NAD+. On observe donc une diminution de l’absorbance, à 450 nm
VI. Les paramètres enzymatiques
Une activité enzymatique est définie par deux principaux paramètres :
- Vmax : vitesse maximale d’activité catalytique d’une enzyme. Elle s’exprime en U : µmol·min-1
- Km : constante d’affinité de l’enzyme. Elle correspond à la quantité de substrat nécessaire pour que vi = ½ Vmax. Km est une concentration.
- On décrit également vi = vitesse initiale de l’enzyme
vi dépend des conditions du milieu et particulièrement de la concentration initiale en substrat : plus il y a de substrat au démarrage, plus la vi est élevée.
Quand [substrat]init est égale à Km, alors vi = ½ Vmax
Quand [substrat]init est 10x supérieure à Km, alors on estime que vi = Vmax
Les temps enzymatiques
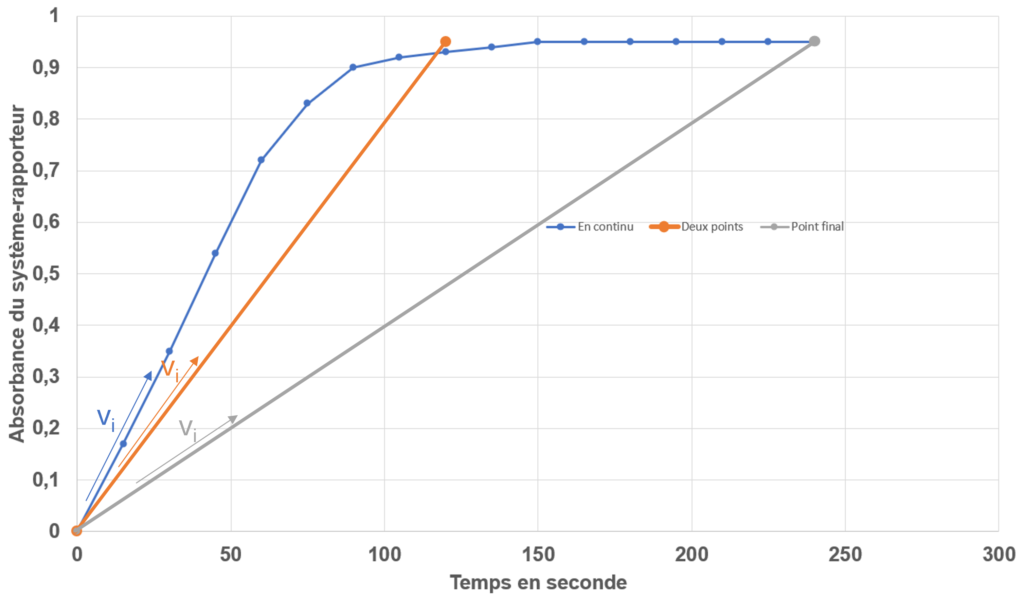
Mesure de l’absorbance du milieu, à des temps réguliers, pour obtenir un profil fidèle de l’évolution de la vitesse de l’enzyme (dérivée de la droite en un point)
Mesure de l’absorbance après un temps de réaction enzymatique. Le temps choisi est suffisamment court (120 à 180 secondes) pour obtenir une vitesse initiale proche de la réalité (en continu)
Mesure de l’absorbance longtemps après le démarrage de la réaction enzymatique. La vitesse initiale obtenue est très éloignée de la réalité, mais la réaction est généralement totale = tout le substrat a été consommé
VII. Les enzymes, outils de dosage
On peut également utiliser les enzymes pour quantifier un métabolite, quand celui-ci est indétectable par les méthodes classiques. Cette approche est très souvent utilisée en immunologie.
Si on cherche à détecter un composé A, alors on peut utiliser une enzyme pour :
- Transformer A en B, avec B détectable
- Transformer A en B, avec B indétectable, mais transformation détectable d’un cofacteur
- Réaliser une cascade de transformation : A→B→C…→N, jusqu’à obtenir un produit détectable, ou la transformation détectable d’un cofacteur. Dans ce cas, chaque réaction est réalisée par une enzyme différente
