Introduction
- Les techniques de chromatographie sont des techniques séparatives : elles permettent de séparer les constituants d’un mélange ;
- La séparation des constituants est basée sur des propriétés physico-chimiques, propres à chaque technique de chromatographie ;
- Le choix d’une technique de chromatographie dépend des propriétés physico-chimiques exploitables pour séparer les constituants, ainsi que de la sélectivité* de la technique ;
- Le résultat aboutit systématiquement à un constituant isolé des autres dans une phase (voir plus loin)
*Sélectivité : terme de métrologie qui définit à quel point une technique est capable de cibles un élément en particulier. Une technique permettant de doser les glucides et moins sélective qu’une technique permettant de doser le glucose uniquement.
I. La notion de phase
- Phase : milieu liquide, solide ou gazeux servant de support ou d’entrainement, lors de la séparation des constituants du mélange ;
- On distingue
- La phase stationnaire : matrice stable et immobile, généralement solide, dont les propriétés physico-chimiques permettent la séparation des constituants ;
- La phase mobile : matrice mobile, toujours fluide (liquide ou gaz), qui permet aux constituants du mélange de se déplacer sur la phase mobile. Ses propriétés physiques peuvent être opposées à celles de la phase stationnaire, pour établir un environnement contrasté ;
- Les propriétés des phases dépendent de la nature chimique des constituants à séparer et de la sélectivité désirée.
II. Les propriétés physico-chimiques utiles en chromatographie
II.A. Celles qui permettent aux constituants de changer de phase
Polarité des molécules
- La polarité va contrôler la phase dans laquelle va se trouver une molécule à la fin de la chromatographie ;
- La polarité est l’équivalent du caractère hydrophile/hydrophobe ;
- La polarité est maximale pour l’eau = 1 ;
- Plus un solvant « s’éloigne » de l’eau (solvant organique), plus la polarité diminue. Elle est extrêmement faible pour les hydrocarbures (ratio carbone + hydrogène/oxygène très faible). On va distinguer :
- Les molécules polaires = hydrophiles : forte affinité pour l’eau, ces molécules vont rester dans la phase la plus polaire ;
- La molécules apolaires = hydrophobes : faible affinité pour l’eau, et forte pour les solvants organiques. Ces molécules vont rester dans la phase la moins polaire.
- Les molécules riches en fonction -SH, -OH ou -COOH, peuvent établir des interactions avec les molécules d’eau et donc sont polaires ;
- Les molécules uniquement constitués de -CH (hydrocarbures) ne peuvent pas établir d’interactions avec l’eau, mais plutôt avec d’autres molécules riches en -CH. Ce sont des molécules apolaires.
Les interactions faibles
- Dans ce cas, il s’agit des interactions qui peuvent exister entre une enzyme et son substrat, ou entre un anticorps et un antigène.
- L’un des partenaires (substrat par exemple) est fixé sur une phase stationnaire. L’enzyme à isoler se trouve dans la phase mobile : au passage sur la phase stationnaire, elle se fixe à son substrat, et se retrouve donc isolée du reste des protéines restées libres dans la phase mobile.
On parle alors de chromatographie d’affinité.
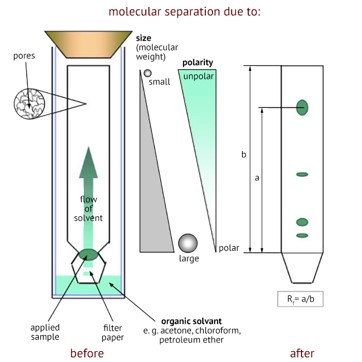
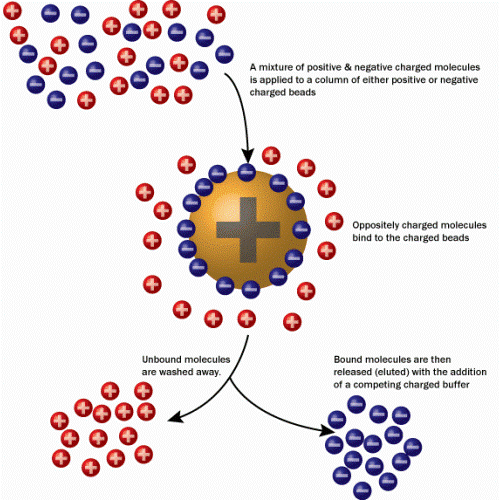
Les interactions électriques
- Dans ce cas, la phase stationnaire possède une charge électrique (+ ou -) ;
- Tous les éléments de la phase mobile qui sont opposés à la charge de la phase stationnaire vont se fixer dessus.
On parle alors de chromatographie échangeuse d’ions
II.B. Celles qui modifient la vitesse de circulation entre les phases
Masse des molécules à séparer
Plus une molécule est lourde, moins elle se déplace vite entre les phases.
Forme des molécules
Les molécules sous forme de fibre se déplacent moins bien entre les phases ou à travers les phases que les molécules en sphère (surtout dans le cas des protéines).
La charge globale des molécules
Dans le cas où la séparation des constituants est basée sur la charge électrique, alors plus une molécule porte de charge, plus elle se déplacera rapidement.
III. TRaitement des constituants séparés
- La séparation des constituants d’un mélange n’est qu’une phase préliminaire au travail d’analyse ;
- Une fois les constituants séparés, on peut :
- Comparer leur comportement à un étalon-interne, et donc les identifier ;
- Faire des analyses structurales, si l’identification par comparaison n’est pas possible ;
- Les quantifier par une méthode colorimétrique ;
- Achever la purification et stocker le constituant isolé pour un usage ultérieur : enzyme, anticorps, …
Le résultat d’une analyse chromatographie peut être de la forme : « Dans l’extrait 1, on a identifié la molécule X à … mol/L, la molécule Y à … mol/L, et la molécule Z à …mol/L. On confirme l’absence de la molécule W, toxique, mais appartenant à la même famille que X, Y et Z. »
IV. Les grands types de chromatographie
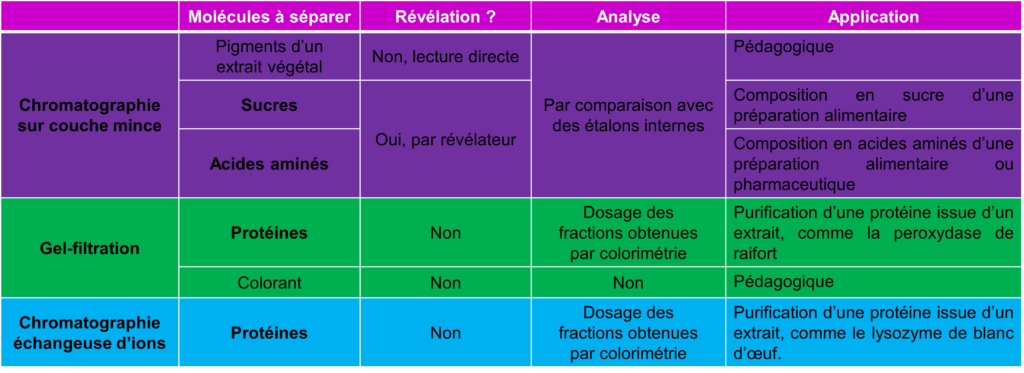
IV.A. La chromatographie sur couche mince CCM

Schéma général
IV.B. La chromatographie échangeuse d'ions
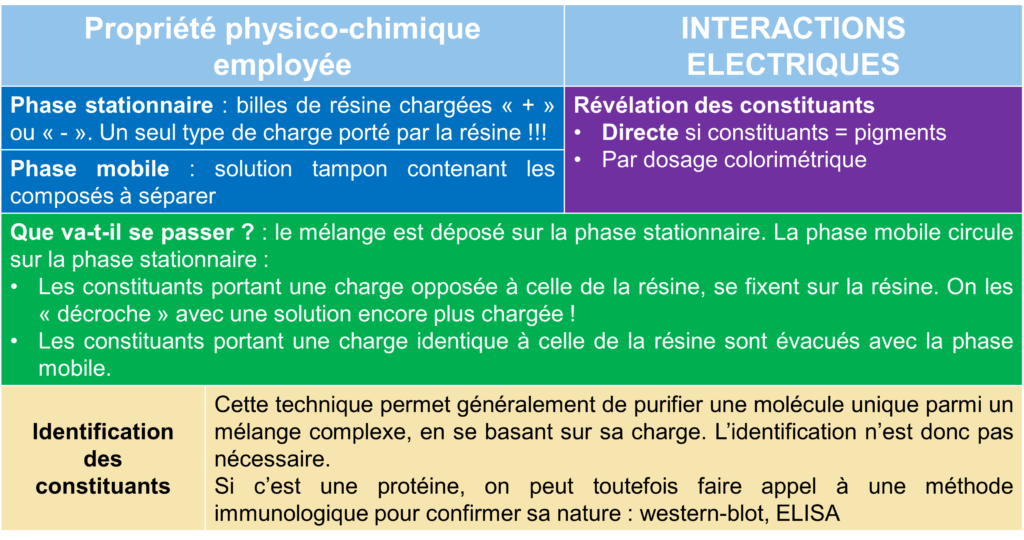
Schéma général
IV.C. La chromatographie par gel-filtration
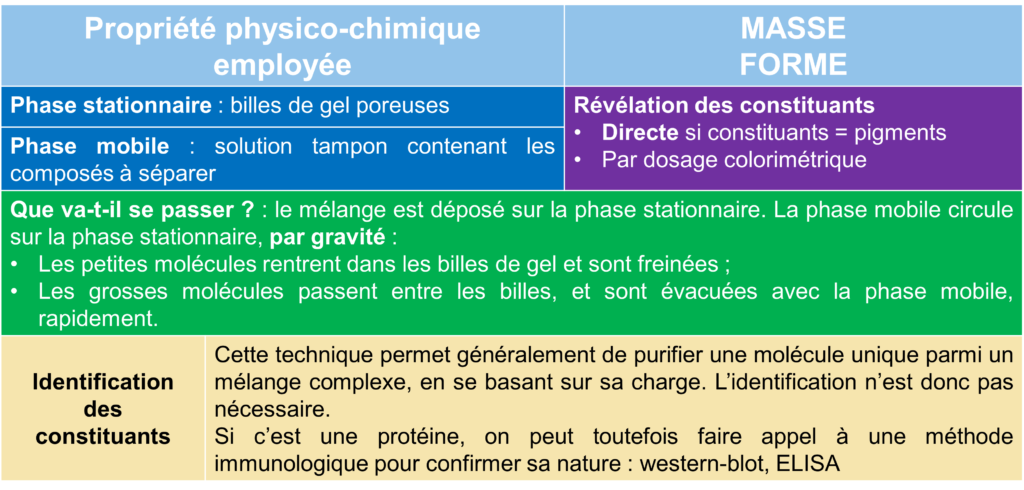
Schéma général

V. applications courantes