La ré-oxydation des cofacteurs par respiration
I. Introduction
Comme cela est dit dans le sous-chapitre 01, la glycolyse produit un certain nombre de cofacteurs réduits, deux par glucose consommé, et qui doivent être ré-oxydés au risque que la glycolyse s’arrête. En effet, la cellule est un espace fini et le stock de cofacteurs oxydés limité.
La cellule doit donc recycler en permanence ses cofacteurs réduits pour maintenir son stock de cofacteurs oxydés.
Le pyruvate, le dernier produit de la glycolyse, est le point de départ de deux stratégies de ré-oxydation des cofacteurs. L’une des stratégies exploite toutes les ressources disponibles dans la cellule, c’est la fermentation (traitée dans le sous-chapitre 03). L’autre stratégie nécessite l’apport d’un accepteur final d’électron, c’est la respiration.
Définition de la respiration : processus métabolique oxydatif cytoplasmique ou mitochondrial permettant la ré-oxydation des cofacteurs réduits, accumulés dans la cellule, tout en produisant de l’ATP. La respiration se fait avec intervention d’un métabolite extérieur : c’est l’accepteur final des électrons. Il peut s’agir du dioxygène, du nitrate, ou d’une molécule organique. Ainsi, la respiration peut se faire en aérobiose (si l’accepteur final est l’O2) ou en anaérobiose. La respiration fait suite à l’oxydation complète du pyruvate en H2O et CO2. Ce processus d’oxydation fait suite à la glycolyse au sein du cycle de Krebs. Plusieurs types de transporteurs d’électrons sont mobilisés NAD+/NADH,H+ et FAD/FADH2.
Ce processus est le plus répandu dans le vivant. La respiration serait apparue il y a 2,48 Ga (précisément) suite à l’accumulation de l’O2 dans l’atmosphère terrestre, sous l’effet de la photosynthèse. Des bactéries chimiolithoautotrophes utilisant la pyrite comme donneur d’électrons auraient été les premières à respirer (article).
Chez les microorganismes, la respiration peut être facultative, comme chez les AAF (aéro-anaérobies facultatifs) ou obligatoire (aérobies strictes). Il existe également un type de bactéries, les microaérophiles, qui respirent le dioxygène mais qui nécessitent une pression partielle (= taux atmosphérique) en O2 différente (et inférieure) à celle de l’atmosphère. Ce taux peut être défini par la réalisation d’un ensemencement en milieu viande-foie. Fiche technique.
II. Le cycle de Krebs
II.A.Activation du pyruvate
A la fin de la glycolyse, le pyruvate peut encore être oxydé mais manque un peu de réactivité. On va donc lui transférer une liaison à haut potentiel énergétique à partir d’un cofacteur : le coenzyme A.

La structure du coenzyme A rappel fortement celle de l’ATP avec :
- Une adénine ;
- Un ribose mais phospho-estérifié sur le sucre en 3′ ;
- Un enchaînement d’acides phosphoriques (2).
Le coenzyme A se termine par une liaison S-H, très réactive, qui permettra de fixer le coenzyme A sur le pyruvate. Dans cette liaison chimique résidera une grande quantité d’énergie.
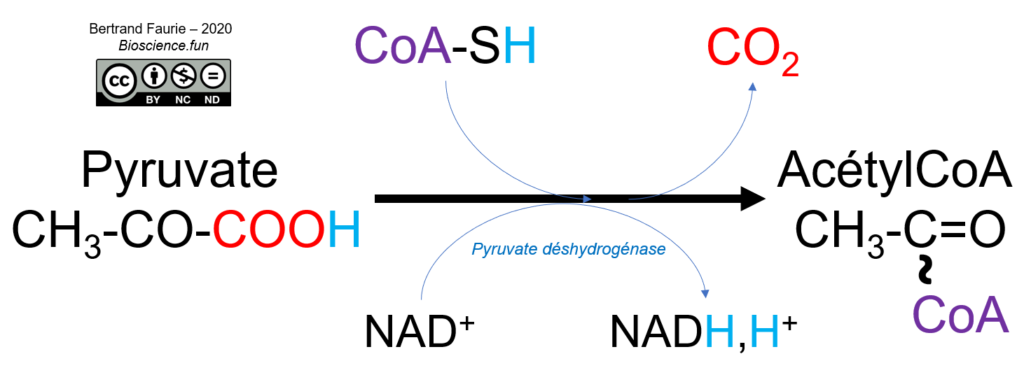
Au cours de la réaction, le pyruvate est décarboxylé (perte de CO2) en acétaldéhyde puis oxydé en acétyl. Le coenzyme est ensuite fixé sur l’acétyl pour former l’acétylCoA.
La pyruvate déshydrogénase est un complexe enzymatique regroupant trois enzymes :
- E1, associée à la thiamine pyrophosphate : elle est responsable de la décarboxylation du pyruvate en acétaldéhyde. La fixation du pyruvate sur la thiamine PP provoque sa décarboxylation ;
- E2, associée à l’acide lipoïque oxydé : l’acétaldéhyde est oxydé par réduction de l’acide lipoïque, ce qui provoque sa fixation covalente sur l’enzyme. Un autre site de fixation est alors libéré pour permettre la fixation du coenzyme A. Les deux substrats sont fixés à l’enzyme jusqu’à leur combinaison, ce qui les libère de l’enzyme ;
- E3, associée au FAD : elle permet la ré-oxydation de l’acide lipoïque de E2 par formation de FADH2 ;
Et le NAD+ dans tout ça ? Il permet de ré-oxyder le FADH2 de E3 qui a permis de ré-oxyder l’acide lipoïque de E2 (oui, c’est une chaîne de transporteurs…).
La décarboxylation du pyruvate est donc associée à une oxydation = décarboxylation oxydative.
II.B.Le cycle de Krebs
Une fois l’acétylCoA synthétisé, il va subir une oxydation totale en eau et dioxyde de carbone, accompagnée d’une production de cofacteurs réduits et d’ATP. La particularité de ce processus est qu’il est circulaire, et permet l’auto-régénération du substrat : c’est le cycle de Krebs.
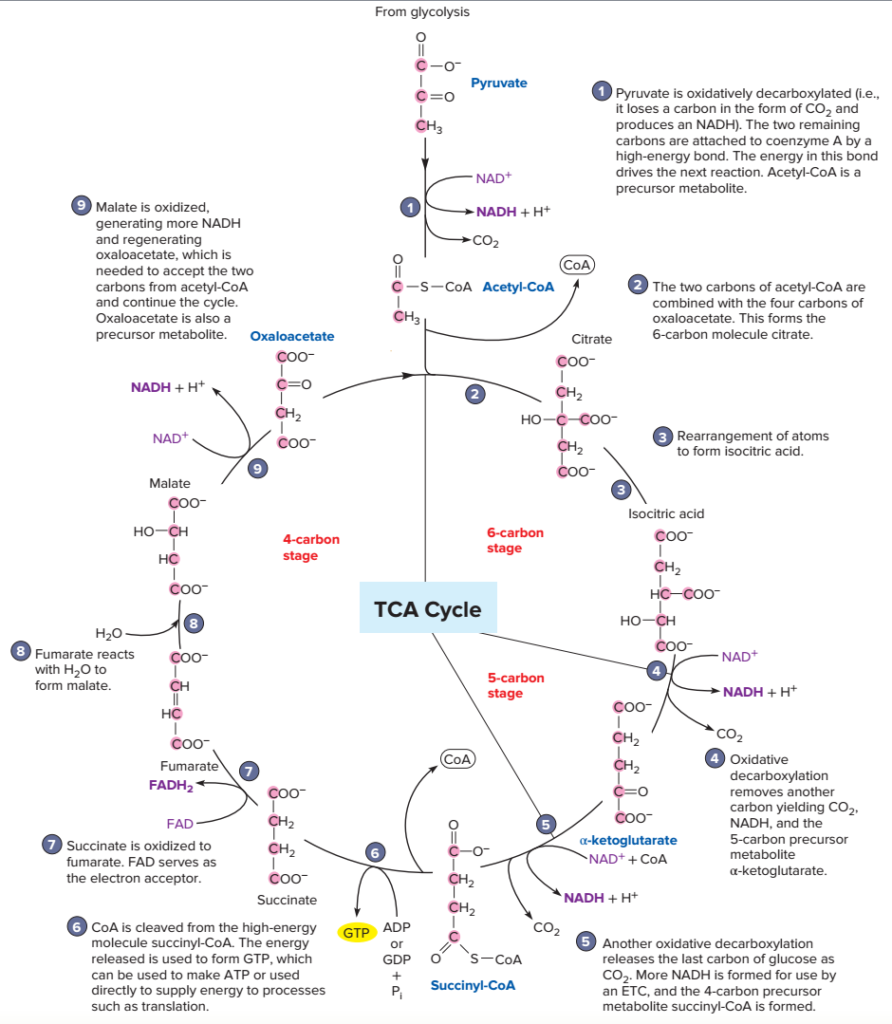
Au cours du cycle de Krebs, on va observer :
- Étapes 4 et 5. Deux décarboxylations oxydatives : élimination d’un CO2 et réduction d’un cofacteur à chacune des étapes ;
- Étapes 7 et 9. Deux déshydrogénations avec production d’un cofacteur réduit à chacune des étapes : FADH2 à l’étape 7 et NADH,H+ à l’étape 9 ;
- Etape 6. Production d’un GTP, forme alternative de l’ATP, utilisée dans certains processus métaboliques. Le GTP peut également être convertit en ATP : GTP + ADP = GDP + ATP.
Une grande partie des réactions du cycle de Krebs a pour objectif de régénérer l’oxaloacétate qui a réagi avec l’acétylCoA en premier lieu. Tout en assurant la conversion totale de l’acétylCoA en énergie…
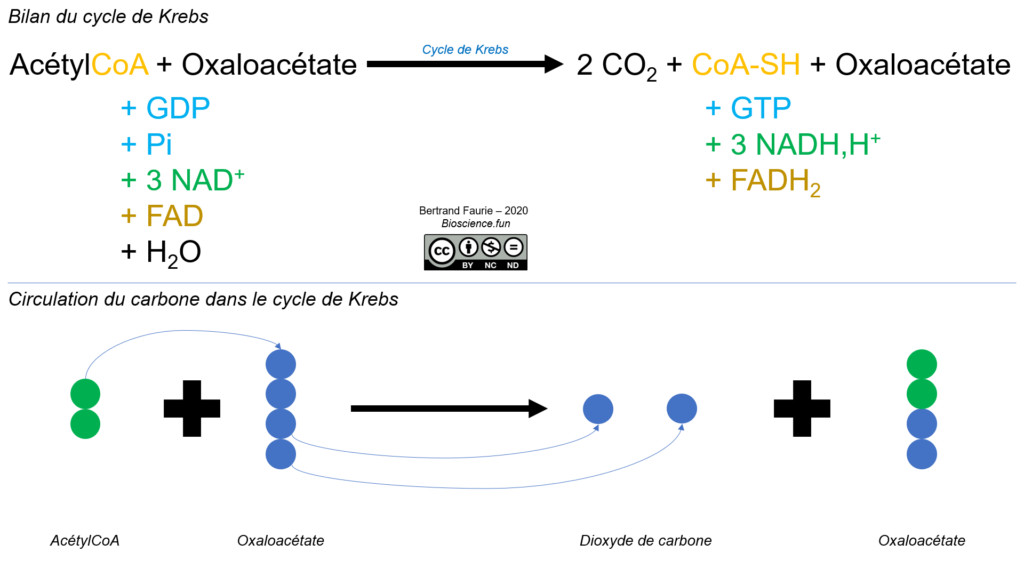
Comme nous l’avions dit pour le pyruvate, l’actétylCoA et le cycle de Krebs sont des carrefours métaboliques, par lesquels passent la quasi-totalité des voies métaboliques.
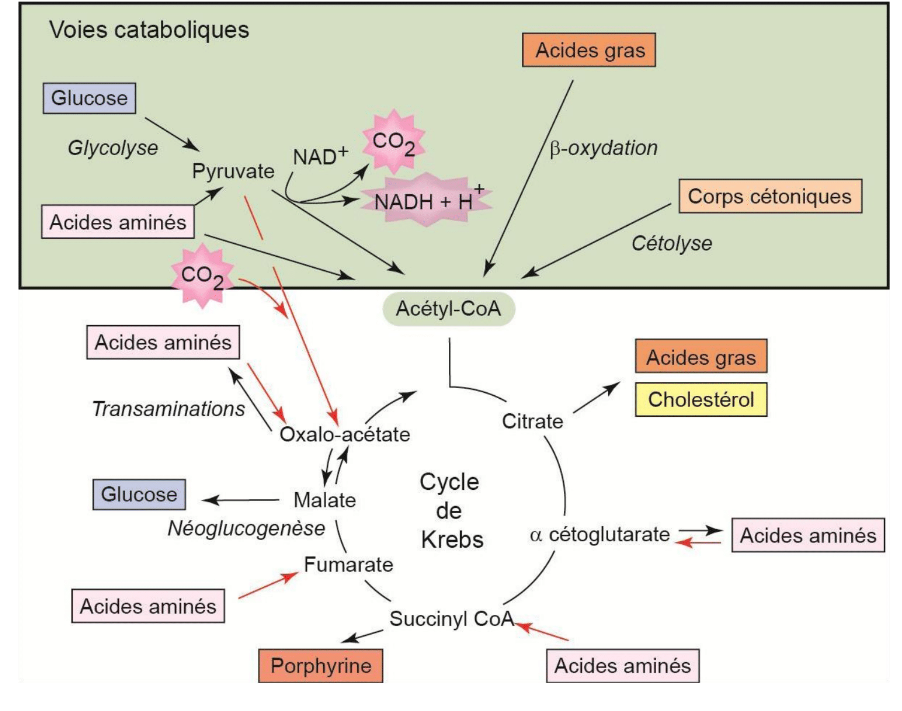
Vers le cycle de Krebs convergent des voies cataboliques :
- La glycolyse (évidemment) ;
- La dégradation des lipides (béta-oxydation) : elle aboutit à l’acétylCoA ;
- La dégradation des corps cétoniques ;
- La dégradation des acides aminés : ils peuvent intégrer le cycle à différent niveau (en amont : pyruvate et acétylCoA) ou directement dans le cycle.
Mais le cycle de Krebs, c’est également des voies anaboliques :
- Re-synthèse du glucose. ATTENTION, ce n’est pas l’inverse de la glycolyse, c’est une voie parallèle = la néoglucogenèse ;
- Re-synthèse des lipides ;
- Re-synthèse des acides aminés ;
- Synthèse des porphyrines : complexes intégrant un ion métallique, comme l’hème de l’hémoglobine.
Le cycle de Krebs est une voie d’anabolisme et de catabolisme : il est amphibolique.
Tous les intermédiaires du cycle de Krebs qui ont été consommés par d’autres voies sont remplacés par des réactions anaplétoriques (remplir à nouveau). Le cycle de Krebs ne s’arrête jamais.
Pour avoir un aperçu rapide des voies métaboliques : carte générale du métabolisme.
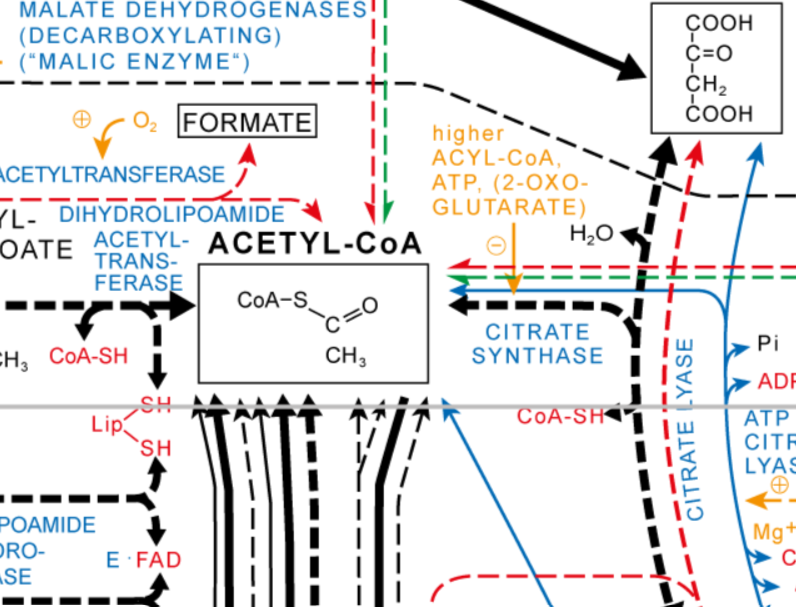
Il est maintenant temps de ré-oxyder tous ces cofacteurs…
III.La respiration
Nous aborderons essentiellement le processus de respiration mitochondriale, qui est le plus étudié. Le mécanisme de respiration bactérienne doit être considéré comme une version ancestrale du processus mitochondrial, dans la cadre d’une théorie endosymbiotique validée : les mitochondries sont des petites bactéries devenues hyper-spécialisées qui ont été absorbées par des bactéries plus grandes, pour former à terme, la cellule eucaryote.
III.A.La mitochondrie
La mitochondrie est un organite cellulaire, présent en très grande quantité dans le cytoplasme des cellules eucaryotes. Autrefois perçus comme des organites figés, sphères individuelles dans le cytoplasme, les résultats récents montrent que les mitochondries forment un réseau ultra-dynamique dans la cellule.
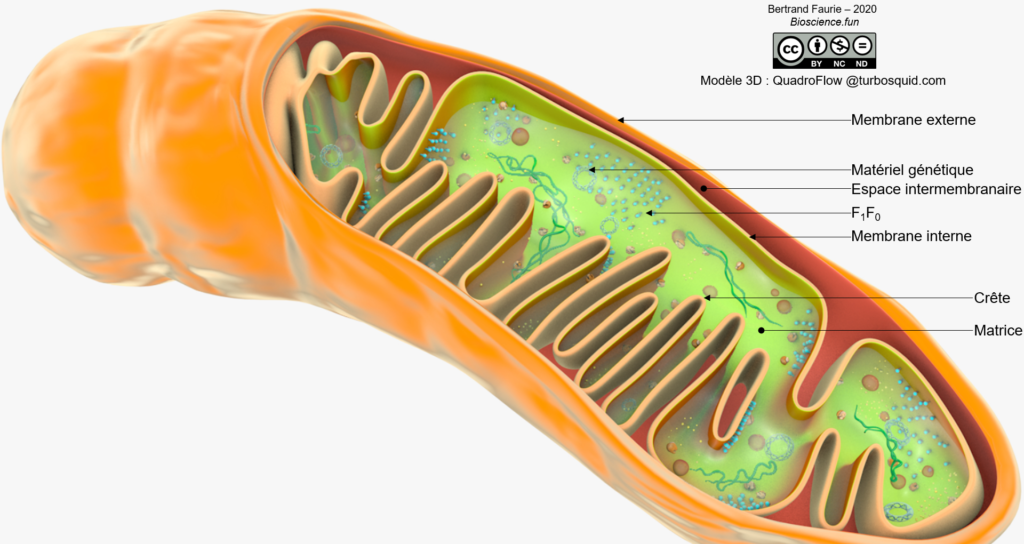
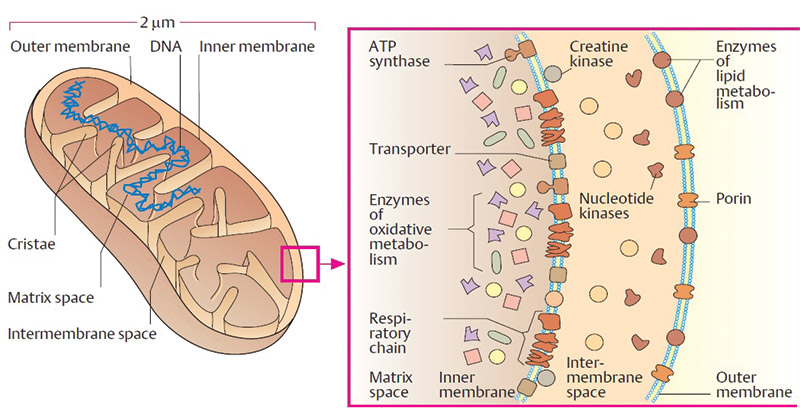
Les deux membranes mitochondriales présentent des différences liées à leur fonction :
- Membrane externe : peu de protéines membranaires, surtout des transporteurs et des enzymes liées au métabolisme des lipides (carnitine transferase I) ;
- Membrane interne : très très riche en protéines, dont l’ATPsynthase, les transporteurs d’électrons et d’autres enzymes liées au métabolisme des lipides (acylcarnitine translocase et carnitine transferase II).
III.B.La chaîne respiratoire
Les cofacteurs réduits par le métabolisme vont être ré-oxydés en transférant leurs électrons à un accepteur final, le dioxygène. La réaction est la suivante :
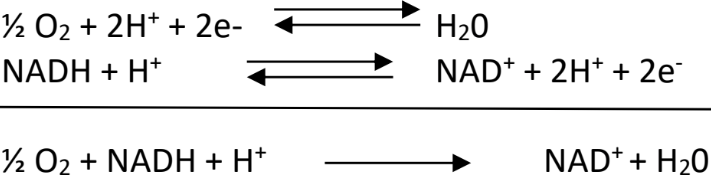
Si on calcule de ΔRG0’ de la réaction, la différence de potentiel rédox entre les deux couples étant importante, on obtient une valeur très élevée :
– 96500 x 2 x (0.82 – (-0.32)) = – 220 kJ/mol.
Multipliée par le nombre de cofacteurs à ré-oxyder, il est peu probable que la mitochondrie supporte une telle libération d’énergie, qui serait notamment dissipée sous forme de chaleur.
Une chaîne de transporteur est donc apparue pour réaliser la même opération, mais en une succession d’étapes à faible ΔRG0’, permettant de limiter les fortes libérations d’énergie. En outre, une partie de l’énergie libérée sera utilisée dans un couplage chimio-osmotique.
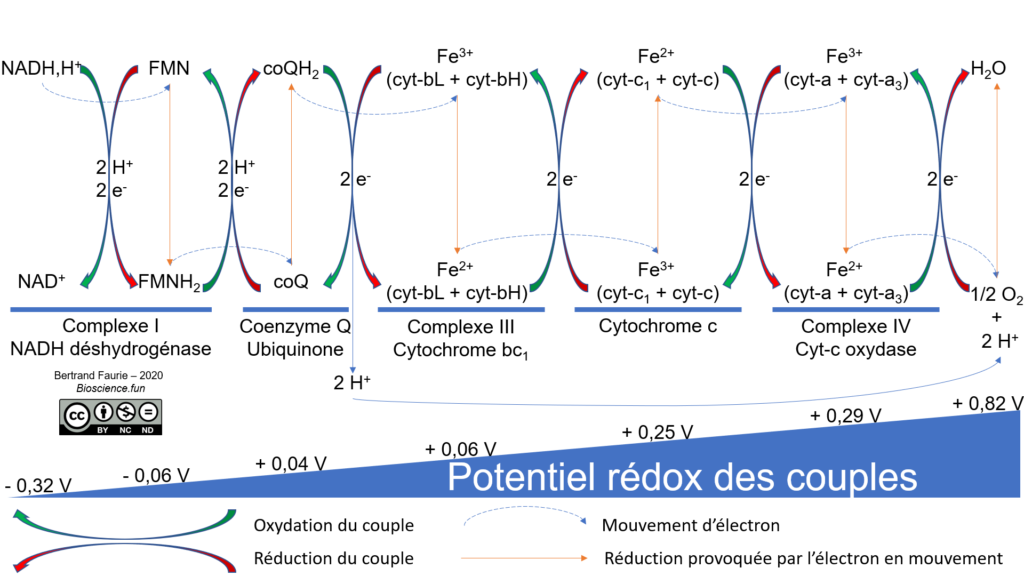
La chaîne de transporteurs (ou chaîne respiratoire) mitochondriale est toujours composée :
- D’une déshydrogénase (complexe I) : elle permet de ré-oxyder le NADH,H+ et le FMNH2 ;
- D’un coenzyme Q : élément mobile de la chaîne, il permet le passage des électrons du complexe I au complexe III ;
- De cytochromes : ce sont des protéines à groupement prosthétique (hème ferrique), qui transfèrent les électrons grâce au couple Fe2+/Fe3+.
Et le complexe II ? Il n’est présent que dans les mitochondries. Il permet de ré-oxyder le succinate en fumarate, deux intermédiaires du cycle de Krebs. Pourquoi ? Parce que le NADH,H+ cytosolique ne peut pas franchir l’enveloppe mitochondriale : il est ré-oxydé directement dans le cytosol, par réduction du fumarate en succinate. Le succinate franchit l’enveloppe mitochondriale, se fait oxyder en fumarate, le fumarate ressort de la mitochondrie et le cycle recommence : c’est une navette d’oxydoréduction.
Le donneur initial d’électron est le NADH,H+ et l’accepteur final est le dioxygène.
Et les protons dans tout ça ?
La ré-oxydation des cofacteurs est très exergonique (- 220 kJ/mol pour le NADH,H+ et – 150 kJ/mol pour le FMNH2). Toute cette énergie n’est pas perdue, ni même dissipée sous forme de chaleur (sinon la cellule prendrait feu…).
Cette énergie libérée est utilisée pour un couplage chimio-osmotique = création d’un gradient de proton trans-membranaire au niveau de la membrane interne de la mitochondrie. Ce gradient permettra de générer une force proton-motrice, exploitée par l’ATP synthase, …. (voir chapitre 01, SC03).
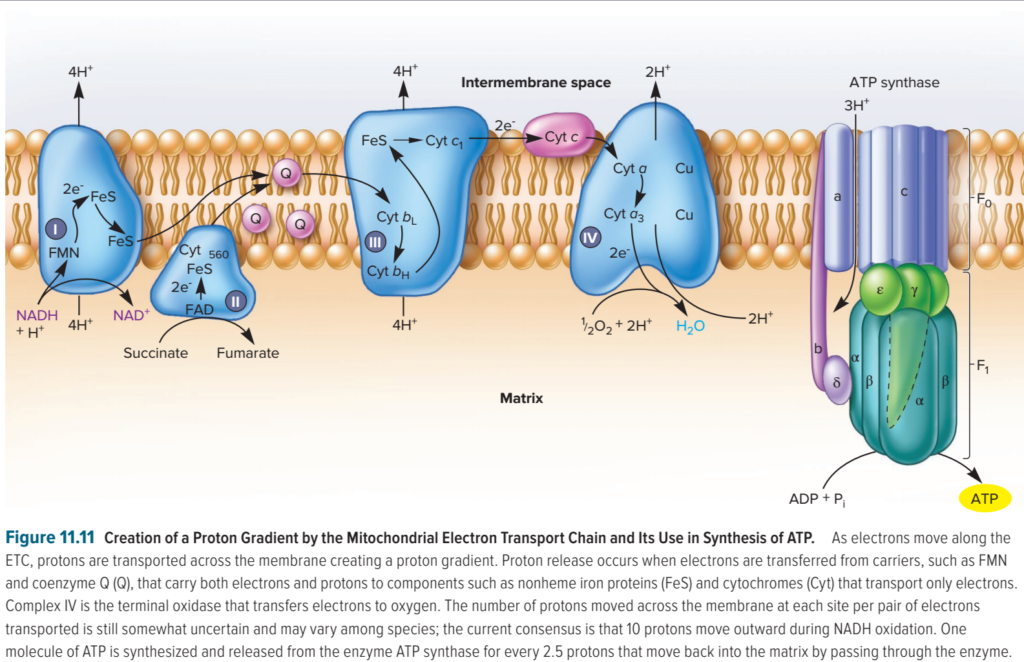
Au niveau des complexes I, III et IV, les réactions d’oxydoréduction, qui accompagnent le transfert des électrons d’un complexe à l’autre, permettent de faire passer des protons de la matrice mitochondriale (matrix) dans l’espace intermembranaire (intermembrane space). Les protons retournent ensuite dans la matrice via l’ATP synthase, ce qui permet de régénérer l’ATP.
- 4 protons sont transportés par le complexe I ;
- 4 protons sont transportés par le complexe III ;
- 2 protons sont transportés par le complexe IV.
III.C.La respiration chez les bactéries
Nous avons vu que les bactéries pouvaient ré-oxyder leurs cofacteurs grâce à la fermentation. Certaines le font par la respiration.
La chaîne respiratoire bactérienne est cytoplasmique, et le gradient de proton s’établit entre l’environnement et la cellule. La chaîne est assez proche du modèle théorique présenté dans le document 0210312. Les bactéries ne possèdent pas de complexe II, puisqu’il est lié à l’imperméabilité de la mitochondrie aux cofacteurs réduits.
On s’intéresse à Paracoccus denitrificans, une bactérie Gram négative (donc à double-membrane et qui possède un périplasme entre les deux), qui a la capacité de respirer les nitrates en conditions anaérobies. Juste en passant, ce serait un parent de la bactérie qui s’est transformée en mitochondrie (théorie endosymbiotique) : on retrouve donc une double-membrane, un espace entre les membranes dans lequel s’accumulent les protons, …
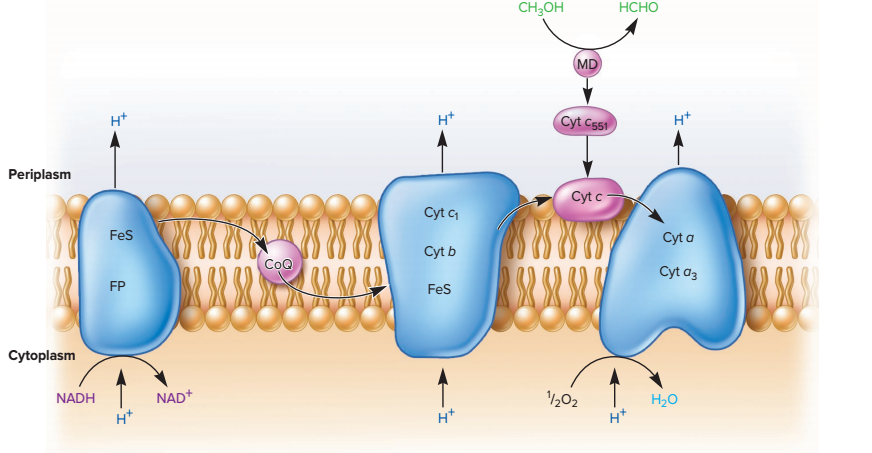
En condition aérobie, l’accepteur final étant le dioxygène, la variation d’enthalpie libre d’oxydation du NADH,H+ par le dioxygène, est la même que dans la mitochondrie : -220 kJ/mol.
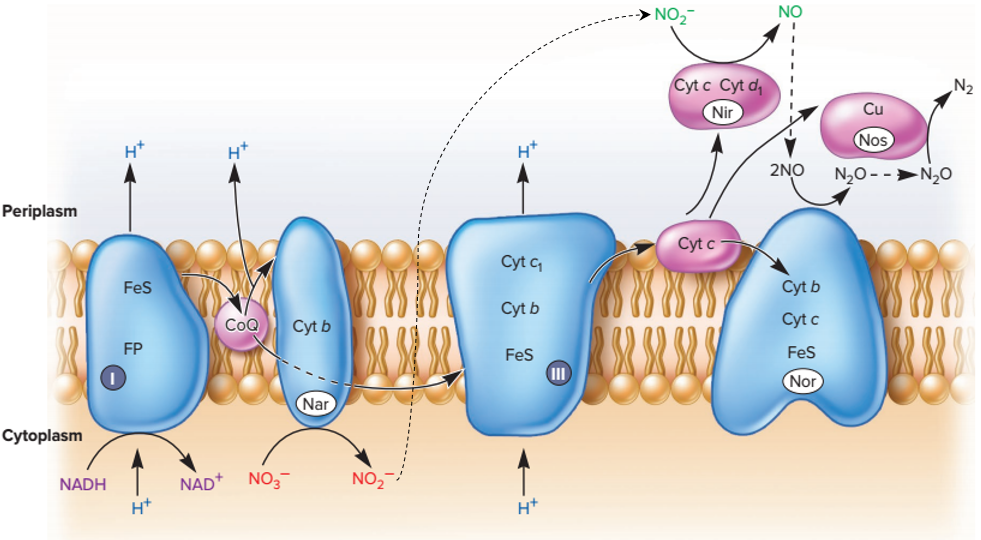
En condition anaérobie, un système plus complexe se met en place. La respiration se passe à cheval entre le cytoplasme et le périplasme, avec des protéines libres évoluant dans le périplasme.
Ces protéines permettent la ré-oxydation des cofacteurs en utilisant le nitrate (NO3–) comme accepteur final, à la place du dioxygène absent. Il s’agit de réductases qui reçoivent les électrons directement du coenzyme Q réduit et du cytochrome C réduit.
En prenant en compte les couples rédox impliqués, on obtient :
ΔRG0’ = – 2 x 96500 x (0.42 – – 0.32) = -143 kJ/mol
La respiration du dioxygène est donc plus énergétique que la respiration du nitrate. On parle de respiration du nitrate, parce qu’il s’agit d’une réduction du nitrate liée à la chaîne respiratoire (transporteurs d’électrons membranaires).
III.D.Bilan de la respiration
Bilan moléculaire
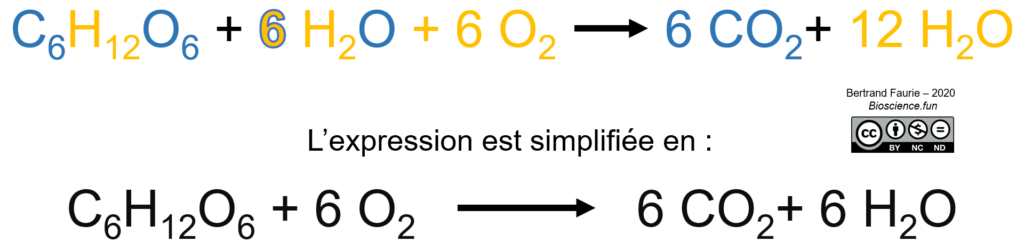
Bilan énergétique
Il existe toujours une incertitude sur les équivalences « cofacteur ré-oxydé – ATP produit », mais en prenant en compte les deux donnés suivantes :
- Il faut 3 protons passant à travers F0 pour que F1 fasse un tour et donc produise 1 ATP ;
- La ré-oxydation d’un cofacteur réduit libère suffisamment d’énergie pour transporter 10 protons à travers la membrane de la chaîne respiratoire.
Voici le bilan énergétique que l’on peut établir depuis la glycolyse jusqu’à la production de CO2 :

