Sous-Chapitre 03 – Le rôle de la force proton-motrice
Nous avons vu dans la partie précédente que le métabolisme est à l’origine d’une grande quantité de cofacteurs réduits et que leur réoxydation permet directement de régénérer l’ATP mais également de mettre en place un gradient de protons (couplage chimio-osmotique). Ce gradient servira par la suite à régénérer l’ATP (couplage osmo-chimique).
Comment est mis en place ce gradient de proton ? Comment fonctionne le couplage osmo-chimique ?
I.Fonctionnement d’une chaîne de transporteurs d’électrons
I.A. Origine des électrons cédés à la chaîne de transporteur
Les électrons cédés à la chaîne de transporteurs d’électron proviennent des cofacteurs réduits par les réactions métaboliques. Voir Sous-chapitre 02, les phosphorylations oxydatives.
I.B. Localisation de la chaîne de transporteurs d’électrons
En fonction des organismes, la chaîne se situe dans des compartiments différents :
- Dans la mitochondrie, chez les Eucaryotes ;
- Dans le cytoplasme, chez les Eubactéries et les Archées ;
- Dans les chloroplastes, chez les organismes photosynthétiques.
La chaîne de transporteurs est systématiquement membranaire : il s’agit de protéine ou non, enchâssées dans une membrane :
- Membrane interne de la mitochondrie ;
- Membrane cytoplasmique, chez les Eubactéries et les Archées ;
- Membrane interne du thylakoïde, dans le chloroplaste.
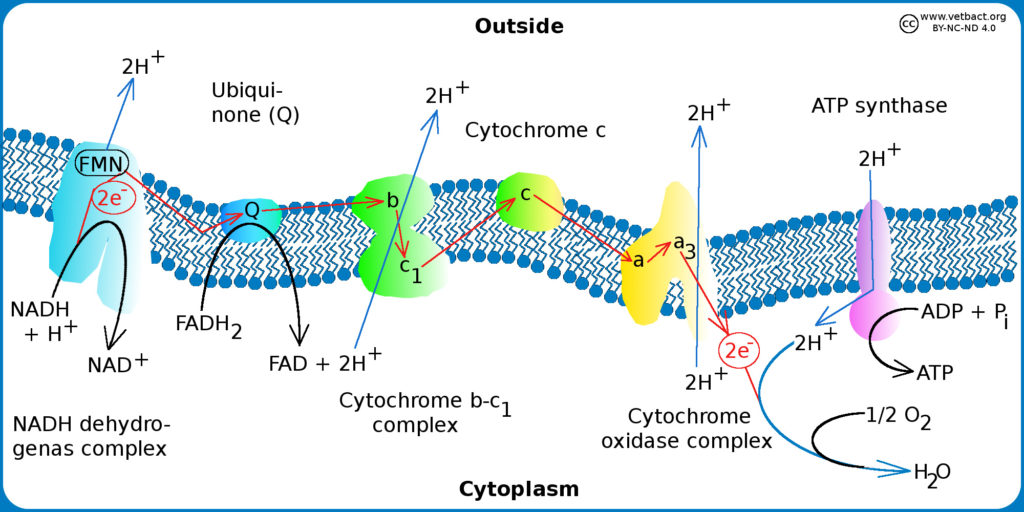
I.C. Organisation des transporteurs dans la chaîne
Les transporteurs ne sont pas placés au hasard dans la chaîne : ils sont physiquement organisés le long d’un gradient de E0‘.
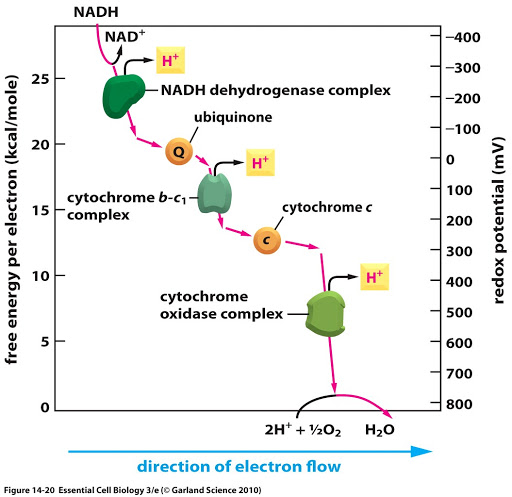
Quelques remarques sur les composants généralement rencontrés dans les chaînes de transporteurs d’électrons :
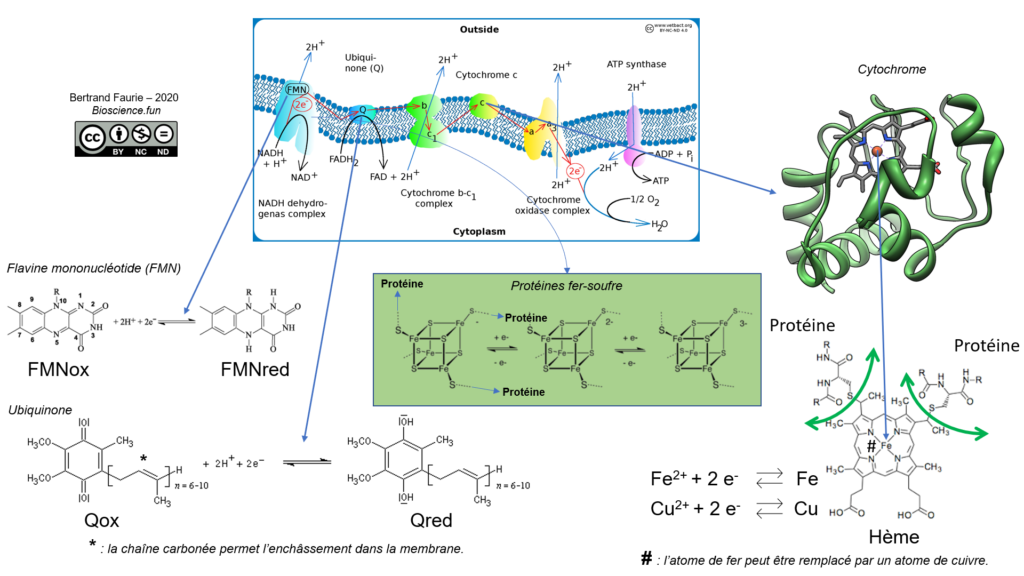
Les électrons sont transférés d’un donneur dont le potentiel rédox est le plus faible vers un accepteur dont le potentiel rédox est plus fort (revoir le sous-chapitre 01) : les cofacteurs métaboliques se retrouvent à l’état oxydé tandis que l’accepteur final (dioxygène généralement) est réduit (sous forme d’eau). Tous les transporteurs de la chaîne passent par un état réduit puis sont aussitôt réoxydés lors du transfert d’électron au complexe suivant.
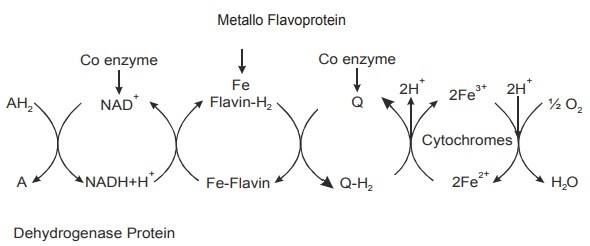
Remarque : lors de la photosynthèse, la réaction est inversée. La fixation du carbone inorganique dans la matière végétale nécessite des cofacteurs réduits, qui seront oxydés lors du processus de fixation. La chaîne de transporteurs permet de récupérer les cofacteurs réduits, selon le même mécanisme que pour la respiration. Les protons rendus aux cofacteurs proviennent de la photolyse de l’eau. Cette photolyse produit un déchet inutile pour la plante : le dioxygène.
II.Gradient de protons et production d’ATP
II.A.Obtention du gradient de protons
Photosynthèse et respiration sont deux mécanismes qui provoquent une circulation très importante de protons, qui s’accumulent d’un côté d’une membrane.
- Espace intermembranaire pour les chloroplastes et les mitochondries ;
- Espace extracellulaire pour les eubactéries et archées (d’où l’acidification du milieu observée au laboratoire).
C’est lors de la réoxydation des cofacteurs ou des différents éléments de la chaîne de transporteur que suffisamment d’énergie est libéré pour assurer le transport de proton contre leur gradient : c’est un couplage chimio-osmotique.
A la façon d’un barrage hydroélectrique, de l’énergie est stockée sous la forme d’une réserve de protons. Les protons auront tendance à se déplacer vers l’espace où ils sont le moins concentrés. L’ouverture des vannes (un peu particulière) permet de mettre en déplacement les ions et donc récupérer cette énergie pour régénérer l’ATP : c’est un couplage osmo-chimique.
Ce gradient particulier est appelé : force proton-motrice !
Remarque : il existe également une force sodium-motrice. Cette fois-ci, ce sont des ions sodium qui sont transportés et mis en réserve. Elle est connue pour alimenter les flagelles bactériens dans certaines conditions physiologiques. C’est surtout le moteur essentiel de la communication nerveuse : le potentiel d’action.
II.B.Obtenir de l’ATP à partir de la force proton-motrice
Les membranes qui permettent le stockage des protons, dans le cadre de la force proton-motrice, sont imperméables aux protons (comme un barrage hydroélectrique). Un seul passage est aménagé pour que les protons puissent rejoindre le compartiment dans lequel ils sont le moins concentrés (revoir les règles de la diffusion ionique dans le sous-chapitre 01). Ce passage, c’est l’ATP synthase ! (on traitera l’exemple de la mitochondrie).
L’ATPsynthase possède deux activités :
- Un canal à proton permettant la circulation des protons selon le gradient = processus très exergonique ;
- Dans la matrice mitochondriale, une tête catalytique permettant la régénération de l’ATP à partir d’ADP = processus endergonique.
C’est un processus osmo-chimique puisque la réaction chimique défavorable est permise par un processus osmotique (la diffusion des protons) très favorable. L’ATP est régénéré par phosphorylation oxydative : l’oxydation des cofacteurs permet de générer le gradient de protons.
II.C.L’ATP synthase
La masse de l’ATP synthase est de l’ordre de 600 kDa, soit 600 000 g/mol. C’est une grosse bestiole.
Bertrand F., biochimiste
L’ATP synthase est un complexe protéique massif, enchâssé dans la membrane des mitochondries, des thylakoïdes chez les eucaryotes. Chez les eubactéries et les archées, on la trouve dans la membrane plasmique.
Première molécule observée en train de fonctionner en temps réel, par microscopie de force atomique : Neff D, Tripathi S, Middendorf K, et al. Chloroplast F0F1 ATP Synthase Imaged by Atomic Force Microscopy. J Struct Biol. 1997;119(2):139-148. doi:10.1006/jsbi.1997.3891
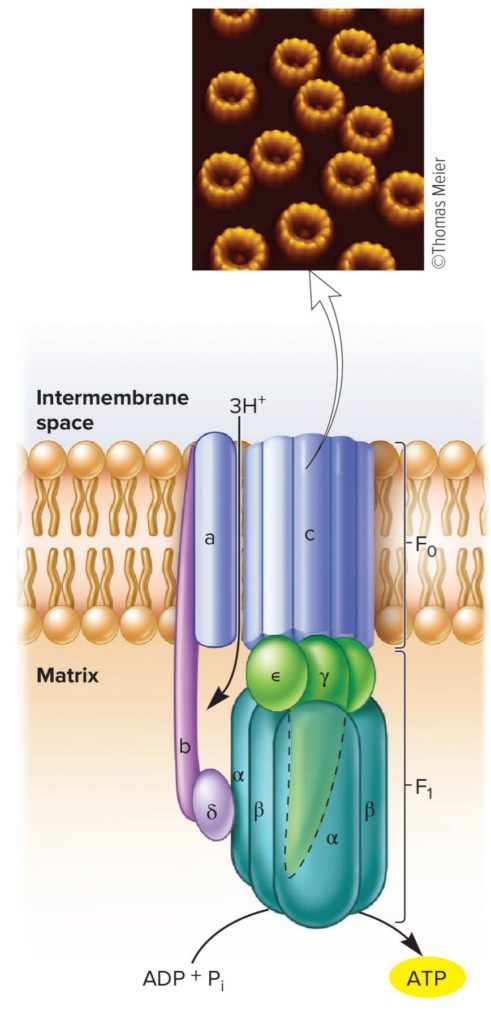
In Immunology, Prescott.
L’ATP synthase est composée de deux parties :
- F0 : intégrée dans la membrane, c’est un canal à proton qui sert de vanne de passage selon le gradient. Elle est constituée de 1 sous-unité (ssu) a, deux ssu b et b’ et de 10 ssu c (très hydrophobes). Séparée de la partie F1, c’est juste un canal à proton. F0 est le rotor du moteur moléculaire ;
- F1 : partie saillante du complexe, dans la matrice mitochondriale, elle est constituée de 3 ssu alpha et 3 ssu béta, disposées en alternance en quartier d’orange = l’ensemble forme un hexamère. Le tout est complété par 3 ssu supplémentaires : delta, gamma et epsilon. Si on détache la sous unité F1 (par lavage de la membrane à faible force ionique), on obtient une activité catalytique de dégradation de l’ATP (l’inverse de l’activité catalytique « naturelle »). F1 est le stator du moteur moléculaire.
Seule l’association de F1-F0 permet le couplage osmo-chimique assurant la régénération de l’ATP.
- Au niveau de F0, des protons rentrent dans le rotor par l’intermédiaire de la ssu a. Les protons se fixent sur les ssu c et font tourner le rotor (anneau des ssu c) ;
- Les protons ressortent de F0 par un « éjecteur » et arrivent dans la matrice mitochondriale ;
- Le mouvement du rotor entraîne la pièce centrale, la ssu gamma ;
- Le mouvement de la ssu gamma provoque le changement de conformation des ssu alpha et béta (la ssu delta sert de point d’ancrage et bloque la rotation de l’hexamère alpha/béta) ;
- Le changement de conformation des ssu alpha et béta permet la synthèse de l’ATP à partir de l’ADP et Pi. En réalité, seules les sous-unités béta synthétisent l’ATP.
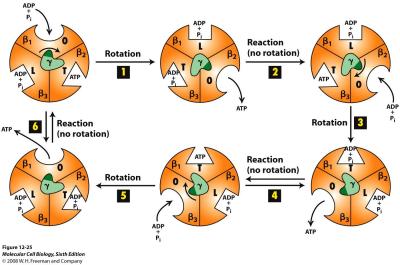
- L’ADP et le Pi rentre dans une sous-unité béta en état O = open (ouverte) ;
- Rotation 1 ;
- La cavité « open » passe en structure L = loose (relâchée) : les deux substrats sont accolés mais n’ont pas réagi ;
- Rotation 2 ;
- La cavité « loose » passe en structure T = tight (serrée) : la force mécanique de serrage provoque la formation de la liaison entre l’ADP et le Pi = génération d’ATP ;
- Rotation 3
- La cavité « tight » passe en structure « open » : l’ATP nouvellement formé est libéré.
Pendant qu’une cavité suit la progression O-L-T, une autre suit la progression L-T-O et la dernière suit la progression T-O-L.
Quelques remarques :
- Les ssu b et delta sont associées pour maintenir en place et empêcher l’autorotation de F1 ;
- Le nombre de protons nécessaires par ATP est variable en fonction de la structure de l’ATP synthase : entre 2 et 4 protons par ATP.
- Le magnésium joue un rôle essentiel dans l’ATP synthase puisqu’il neutralise les charges négatives des acides phosphoriques ;
- En cas d’accumulation d’ATP, l’ATP synthase peut fonctionner à l’envers et consommer de l’ATP pour reformer le gradient de proton.
Bilan : 3 ATP sont synthétisés par tour complet de rotor. Le nombre de protons nécessaires dépend du nombre de sous-unités c : pour 10 ssu c, il faut 10 protons pour faire un tour, soit 3,3 H+/ATP.
Appendice : mieux comprendre le document 010306, avec les connaissances acquises :
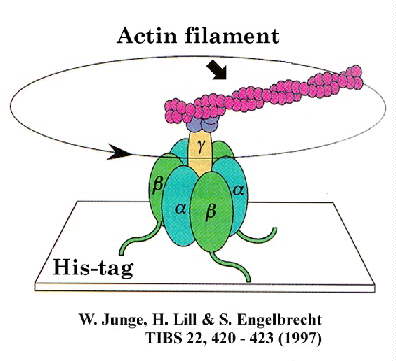
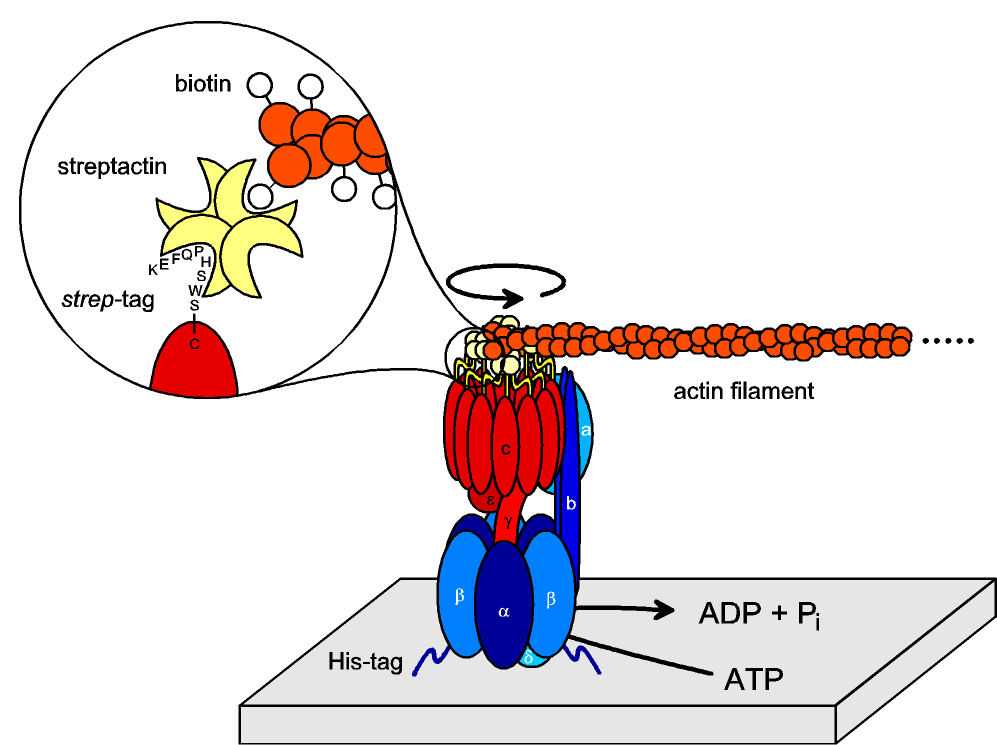
Ultime remarque : les « étiquettes histidine » et le système « streptavidine-biotine » sont deux procédés essentiels de la purification des protéines. Ils devront être maîtrisés (comme tout le reste d’ailleurs…).
