Sous-Chapitre 01 – Rappels
Pour fonctionner, s’édifier et se reproduire, tous les organismes ont deux besoins essentiels : de la matière, essentiellement sous forme de molécules carbonées, et de l’énergie, pour assurer la transformation de la matière, selon les plans particuliers de l’espèce.
L’ensemble des réactions chimiques permettant la transformation de la matière dans un organisme est appelé le métabolisme.
Le métabolisme est divisé en deux familles de réactions :
- Le catabolisme = dégradation des grosses molécules en molécules plus petites (3 à 5 atomes de carbone) qui s’accompagne d’une libération importante d’énergie, sous la forme de production d’ATP ou de cofacteurs réduits (NAD(P)H,H+ ou FADH2) ;
- L’anabolisme = biosynthèse de molécules complexes, souvent de grande taille (protéines, acides nucléiques, lipides, ou polyosides) nécessitant une consommation d’énergie importante (hydrolyse d’ATP en ADP) pour permettre la fabrication des liaisons covalentes. Ce processus s’accompagne également d’une consommation de cofacteurs réduits. Note : les stéroïdes anabolisants sont des hormones proches de la testostérone, stimulant la fabrication de protéines dans les muscles, ce qui entraîne un gain de masse musculaire.
Le métabolisme n’est pas un assemblage de réactions individuelles et isolées : souvent le produit d’une réaction sert de réactif pour une autre réaction. Le procédé peut se répéter plusieurs fois : il se forme alors une chaîne de réactions, appelée voie métabolique. Il existe une ou plusieurs voies métaboliques caractéristiques de chacune des familles de biomolécules : protéines, lipides, glucides et acides nucléiques.
Des métabolites intermédiaires, universels, permettent de passer d’une voie à l’autre. C’est le cas notamment de l’acétylcoA. Ces métabolites permettent par exemple de fabriquer des lipides à partir de glucides (on l’expérimente après chaque réveillon de Noël, quand l’abus de chocolat nous empêche de fermer notre pantalon…).

Dans le tableau de fréquence des métabolites chez E. coli, on trouve logiquement que les métabolites énergétiques (ATP/ADP, NAD/NADH et phosphates) sont les plus utilisés. L’eau est en première position car la majorité des réactions chimiques impliquent la consommation ou la production d’une molécule d’eau.
I.Rappels de thermodynamique
I.A. L’enthalpie libre de réaction
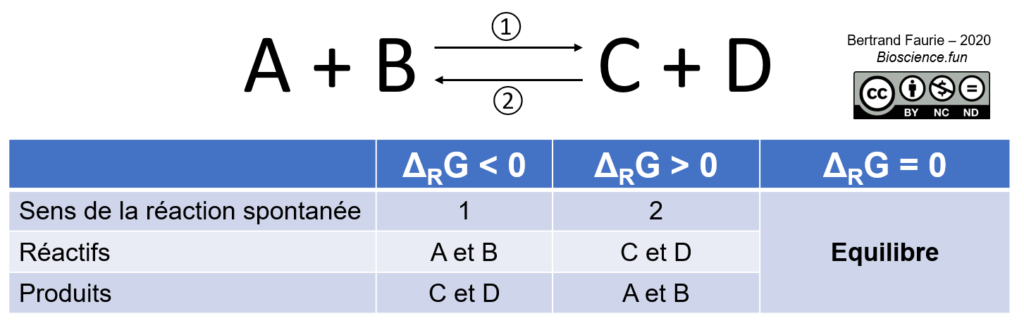
Définition : l’enthalpie libre d’une réaction chimique traduit sa capacité à avoir lieu. Elle est noté G. On s’intéresse avant tout à son évolution au cours d’une réaction chimique : son évolution est notée ΔRG. Deux cas sont possibles :
- ΔRG > 0, la réaction chimique ne peut pas avoir lieu spontanément. On dit que la réaction est endergonique ;
- ΔRG < 0, la réaction chimique peut avoir lieu spontanément. On dit que la réaction est exergonique.
Attention ! ΔRG n’a pas d’influence sur la vitesse de la réaction. Certaines réactions sont très rapides et d’autres très lentes même si elles sont spontanées.
Notez que la réaction est également exothermique : dégagement de chaleur.
Généralement, les réactions exergoniques sont également exothermiques, c’est à dire qu’elles dégagent de la chaleur. En revanche, les réactions endergoniques sont souvent endothermiques, elles refroidissent l’environnement.
I.B. Comment déterminer la valeur de ΔRG ?
Avant de déterminer la valeur du ΔRG d’une réaction (en prenant en compte toutes les variations liées à l’environnement de la réaction), il est nécessaire de déterminer un ΔRG, observé dans des conditions réactionnelles idéales : on parle alors de ΔRG0. Il faut donc définir ces conditions réactionnelles standards. Les chimistes l’ont fait :
- Température = 298 K (kelvins) soit 25°C ;
- Pression = 1 atmosphère soit 1,01325 bar ;
- Concentration des réactifs et des produits = 1 mole/L ;
- pH = 0.
Les biochimistes ont argumenté que la valeur de pH était peu compatible avec l’environnement biologique, et ont donc modifié les conditions standards du ΔRG0 qui devient ΔRG0‘ :
- Température = 298 K soit 25°C ;
- Pression = 1 atmosphère soit 1,01325 bar ;
- Concentration des réactifs et des produits = 1 mole/L ;
- pH = 7.
Deux paramètres peuvent éloigner une réaction de ses conditions standards, en biochimie :
- La valeur du pH : toutes les cellules n’ont pas un pH cytoplasmique à 7 et les organites comme les chloroplastes (stroma) et les mitochondries (matrice) ont un environnement plutôt basique (proche de 8). Variations de pH observées dans les cellules.
- Les concentrations en réactifs et produits : les conditions standards prévoient un ratio de 1/1, alors que dans les chaînes métaboliques le produit sert souvent de réactif à une autre réaction, sa durée de vie est donc limitée et sa concentration maintenue faible.
Notez que ΔRG dépend également de la température du système (ΔRG = ΔH – T.ΔS). Dans les conditions biologiques, la variation de T est assez faible (273 à 363 K en général), elle est arbitrairement réglée à 298 K.
Maintenant que nous avons défini ΔRG0‘, nous allons pouvoir l’utiliser pour déterminer ΔRG’ (on ajoute le symbole ‘ pour signifier que l’on se place dans un environnement biologique), tout en prenant compte les conditions réactionnelles de l’environnement, essentiellement les concentrations en réactifs et produits.

ΔRG’ s’exprime en kJ par mole.
I.C. Que se passe-t-il à l’équilibre ?
L’équilibre est une situation particulière durant laquelle les concentrations en produits et réactifs n’évoluent plus. On définit alors une constante K0, la constante d’équilibre :
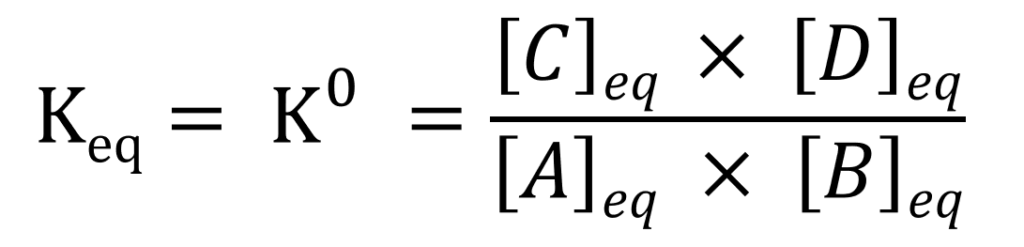
Or à l’équilibre, ΔRG’ adopte une valeur particulière : 0 kJ/mol. On peut en déduire que :
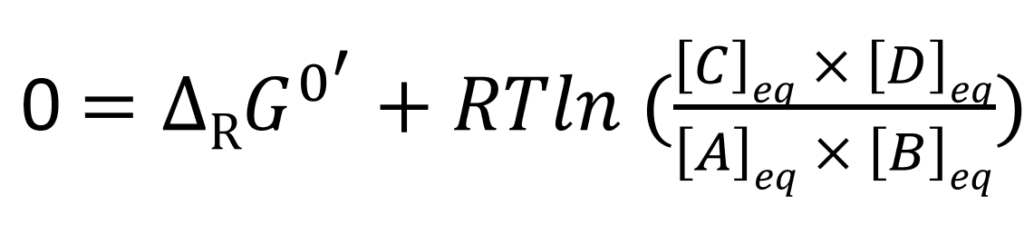
Et donc que :
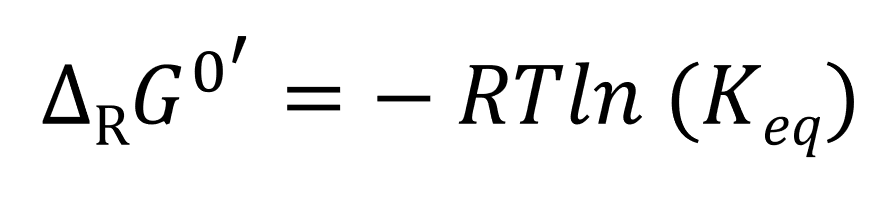
On exprime alors Keq en fonction de ΔRG0‘ :
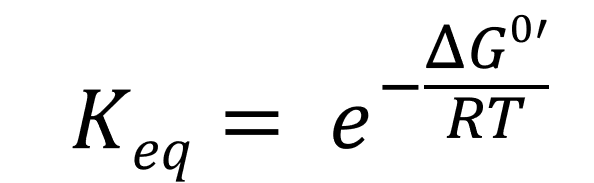
Quelles sont les conséquences de cette relation ?
- Keq dépend de la température de l’environnement !
- En comparant QR’ à Keq, on peut savoir si la réaction sera spontanée ou non :

ATTENTION ! Ne pas confondre K (unité) et K0 (grandeur) !
II. Réactions d’oxydo-réduction
II.A. Couples d’oxydo-réduction

Le E0 s’exprime en volt.
II.B. La règle du gamma
Comment peut-on prévoir le sens de la réaction d’oxydo-réduction, en se basant sur l’échelle des potentiels E0 ? En appliquant la règle du gamma.
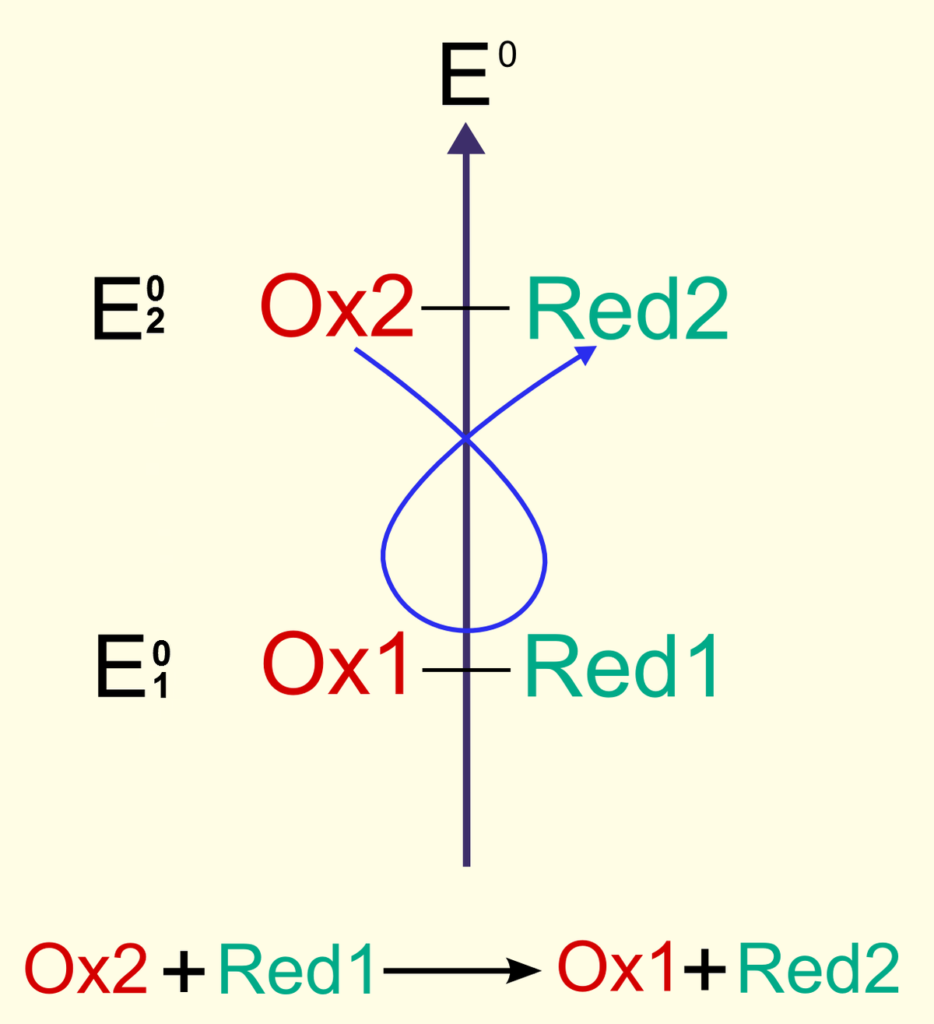
La règle du gamma prévoit que la réaction est spontanée entre l’oxydant du couple ayant le E0 le plus fort, avec le réducteur du couple ayant le E0 le plus faible.
De la même façon que pour G (enthalpie libre), il existe un E et un E’, plus compatible avec les conditions biologiques des réactions d’oxydoréduction. Une différence majeure avec l’enthalpie libre est que E’ et E0‘ sont considérés comme très proches. Les calculs se font donc directement à partir de l’échelle des potentiels rédox.
II.C. Potentiel rédox et variation d’enthalpie libre

III. Les couplages
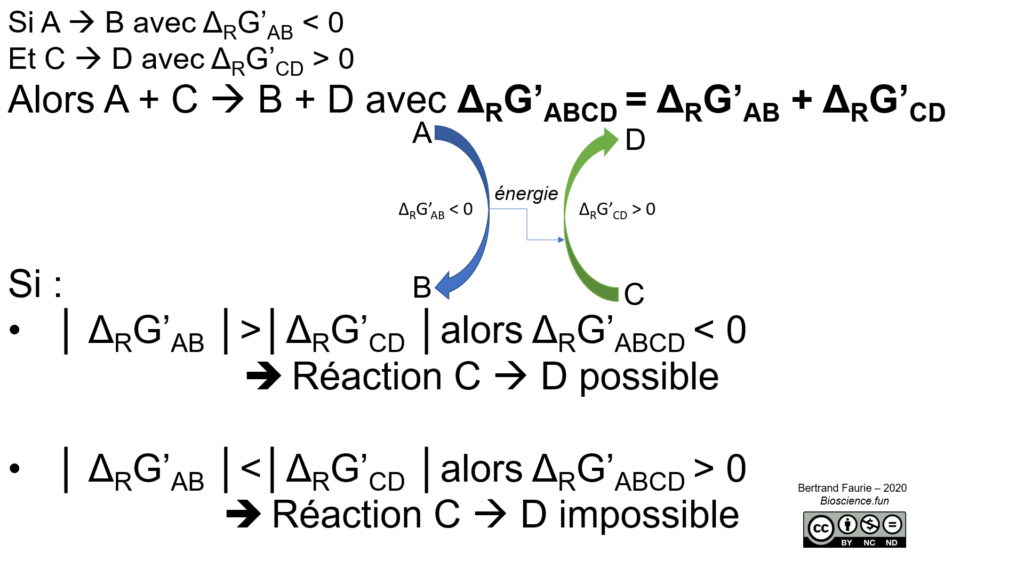
Si les réactions endergoniques, l’anabolisme de façon général, sont impossibles en l’état, comment peut-on fabriquer de la matière et édifier un organisme ?
En leur apportant l’énergie issue d’une réaction exergonique : c’est le couplage !
III.A. Principe thermodynamique du couplage
III.B.Stratégies de couplage dans la cellule
III.B.1.Le couplage chimio-chimique : exemple traité dans le III.A : association d’une réaction très favorable (ΔRG’ très négatif) avec une réaction moins favorable (ΔRG’ positif). Le couplage le plus répandu est le craquage d’ATP en ADP (voir liste des molécules utilisées par E. coli), qui libère -30,5kJ/mole. En cas de réaction plus gourmande en énergie, on peut hydrolyser l’ATP en AMP en libérant deux phosphates = -32,5 kJ/mole.
III.B.2.Rappel sur la diffusion : la diffusion est un processus naturel d’équilibrage des concentrations en solutés de part et d’autre d’une membrane semi-perméable (membrane plasmique). Les entités (ions ou molécules) circulent à travers la membrane jusqu’à ce que la concentration soit identique de part et d’autre de la membrane. Les entités se déplacent toujours de la zone la plus concentrée vers la zone la moins concentrée : on dit qu’elles suivent le gradient de concentration.
La diffusion est un phénomène essentiel dans le fonctionnement des cellules, qui exploite ce mouvement naturel dans de nombreux processus.
III.B.3.Le couplage chimio-osmotique : dans ce cas, une réaction exergonique permet de maintenir un déséquilibre ionique de part et d’autre d’une membrane plasmique.
Pourquoi ce déséquilibre ? Pour la plupart des cellules, les concentrations intracellulaires et extracellulaires en ions sont différentes. Ce déséquilibre provoque une polarité de la membrane plasmique, généralement chargée positivement à l’extérieur (côté extracellulaire) et négativement à l’intérieur (côté intracellulaire). Ce déséquilibre est notamment essentiel à la communication nerveuse !

Comment maintenir le déséquilibre ? Le déséquilibre peut être rompu soit par diffusion accidentelle mais limitée à travers la membrane, soit par ouverture volontaire de canaux ioniques. Pour cela, il faut une pompe.
La pompe Na+/K+ ATPasique : cette pompe lutte contre la tendance naturelle des ions à s’équilibrer de part et d’autre de la membrane. Pour cela, la pompe fait circuler les ions contre leur gradient de concentration, ce qui nécessite de l’énergie (comme faire remonter de l’eau le long d’une pente = on utilise également une pompe).
La pompe utilise l’énergie libérée par la réaction d’hydrolyse de l’ATP en ADP (-30,5kJ/mole) pour modifier sa conformation 3D et ainsi transporter les ions Na+ contre leur gradient de concentration. Par effet rebond, le retour à la conformation initiale de la pompe permet de faire basculer les ions K+ contre leur gradient.
L’énergie libérée par une réaction chimique exergonique favorise un processus osmotique endergonique : couplage chimio-osmotique !
III.B.4.Le couplage osmo-chimique : dans ce cas, un processus de diffusion permet de libérer suffisamment d’énergie pour qu’il favorise une réaction chimique endergonique. Il s’agit du processus-miroir du couplage chimio-osmotique.
Ce processus est principalement illustré par la force proton motrice = FPM. Elle sert notamment à régénérer l’ATP ou à assurer le mouvement des flagelles. La régénération de l’ATP sera vue en détail dans le sous-chapitre 03.
L’énergie libérée par la circulation d’ions le long d’un gradient favorise un processus chimique endergonique : couplage osmo-chimique !
