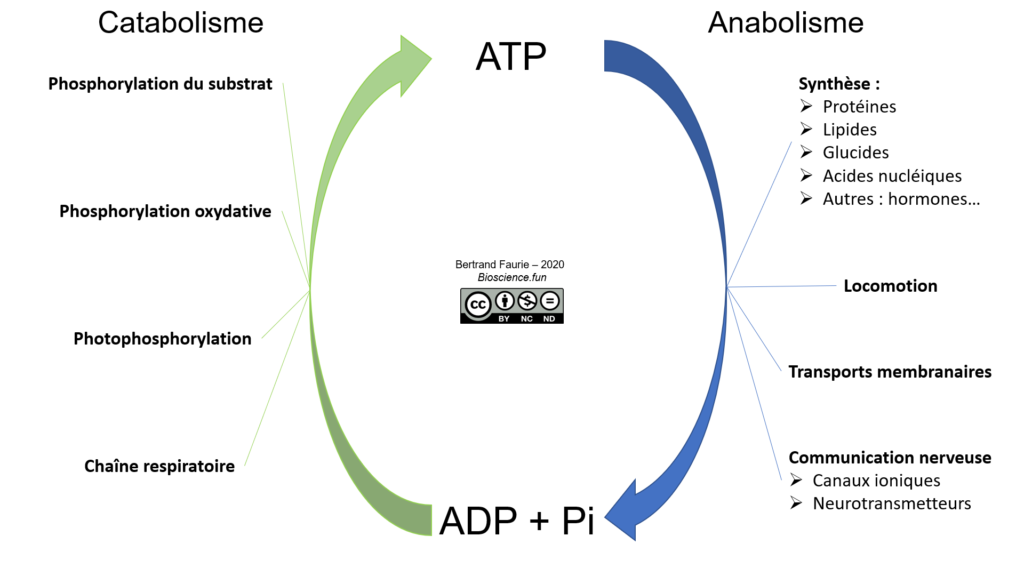
Sous-Chapitre 02 – L’ATP, intermédiaire énergétique
Nous avons vu dans la partie précédente que l’ATP est l’une des molécules les plus fréquentes dans le métabolisme de E.coli et qu’il intervient dans le couplage chimio-chimique et chimio-osmotique.
Quelles sont les particularités de l’ATP qui font de lui un acteur majeur de la bioénergétique ?
I.Les composés à haut-potentiel d’hydrolyse
I.A. Les liaisons covalentes, une source d’énergie
Dans les molécules, la source de l’énergie libérée par les réactions chimique réside dans les liaisons covalentes.
Ces liaisons durables entre deux atomes sont difficiles à casser mais libèrent beaucoup d’énergie. Toutes les liaisons ne se valent pas : certaines sont peu énergétiques et certaines sont très énergétiques. Ces liaisons très énergétiques sont qualifiées de « à haut potentiel énergétique ».
Cette variation d’énergie entre les liaisons est directement liée aux atomes impliqués dans la liaison. En biochimie, ce sont les liaisons impliquant le soufre (CoA-SH) et le phosphore (groupements phosphates en série dans l’ATP, molécules phosphorylées, …) qui sont les principales sources d’énergie.
Remarque : comme toujours, ce qui est vrai dans les systèmes biologiques ne l’est pas forcément en chimie. Toutes les liaisons cassées ne libèrent pas d’énergie ; toutes les fabrications de liaisons ne sont pas énergivores.
I.B. Le cas de l’ATP
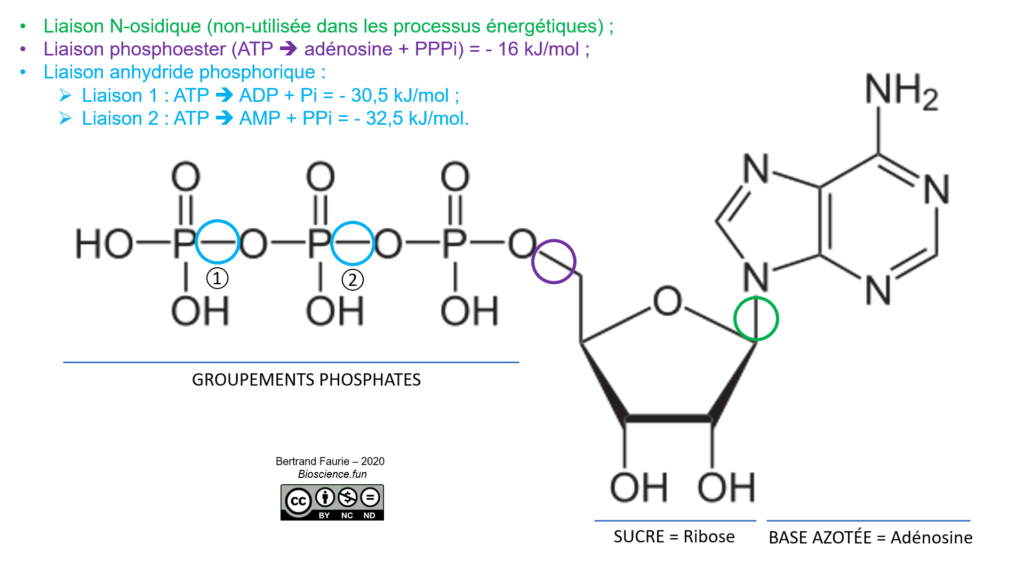
Remarque : sur les figures, les liaisons très réactives sont représentées par le symbole : ~
Les valeurs de la figure précédente sont à pondérer : il s’agit des ΔRG0‘, donc mesurées dans des conditions standards, qui ne sont pas forcément celles de la cellule. Dans le sous-chapitre 01, nous avions précisé que deux paramètres étaient susceptibles d’influencer la valeur de ΔRG0‘ : le pH et les concentrations biologiques.
Le pH aura peu d’impact si on se place dans le cytoplasme (pH proche de 7). MAIS les concentrations vont profondément modifier les valeurs des ΔRG0‘.
Dans le cas de l’hydrolyse de l’ATP en ADP + Pi :

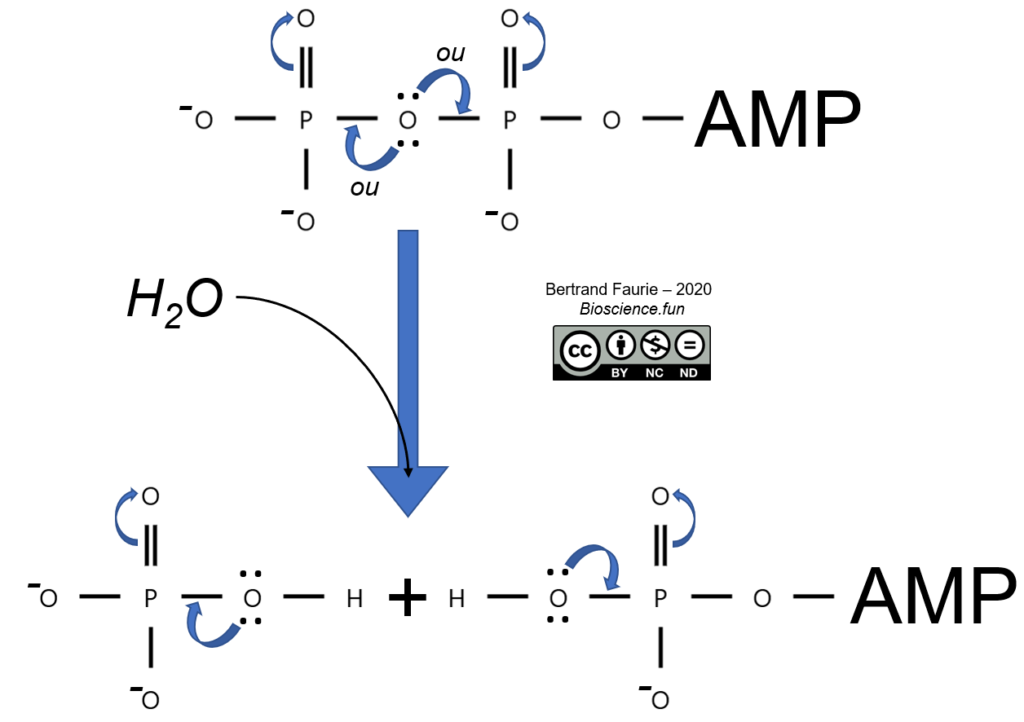
Document 010204. Les produits de l’hydrolyse de l’ATP sont plus stables que l’ATP. En effet, après hydrolyse :
- Plus de compétition entre les groupements phosphoryles et les doublets d’électrons non-liants du « pont-oxygène » ;
- Disparition de certaines répulsions électrostatiques entre les charges négatives portées par les oxygènes ;
- Solvatation des produits d’hydrolyse, ce qui les stabilise encore plus.
Au fur et à mesure de le déphosphorylation de l’ATP, il y a une diminution de l’énergie libre de réaction.
L’hydrolyse de l’ATP est une réaction assez lente, malgré tout :
- La liaison anhydride d’acide entre deux acides phosphoriques se caractérise par une énergie d’activation assez élevée. L’énergie d’activation est l’énergie à apporter à un système pour qu’il réagisse. Cette énergie existe même pour des réactions exergoniques (voir schéma ci-dessous) ;
- L’ATP est donc stable dans les conditions physiologiques (pas d’apport de l’énergie d’activation). Mais facilement hydrolysé par une enzyme (dont le rôle est notamment de faire disparaître l’énergie d’activation !)
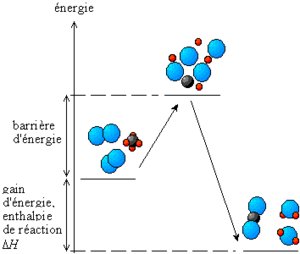
Document 010205. Principe de l’énergie d’activation : pour que des réactifs réagissent entre eux, ils doivent passer par un état « excité », qui se fait par apport d’énergie thermique. Cette énergie est « remboursée » par l’énergie d’enthalpie, libérée par la réaction.
Les enzymes sont des catalyseurs, car elles font quasiment disparaître cette énergie d’activation.
L’ATP occupe une place intermédiaire dans le métabolisme en raison de la valeur moyenne de son ΔRG0‘ d’hydrolyse.
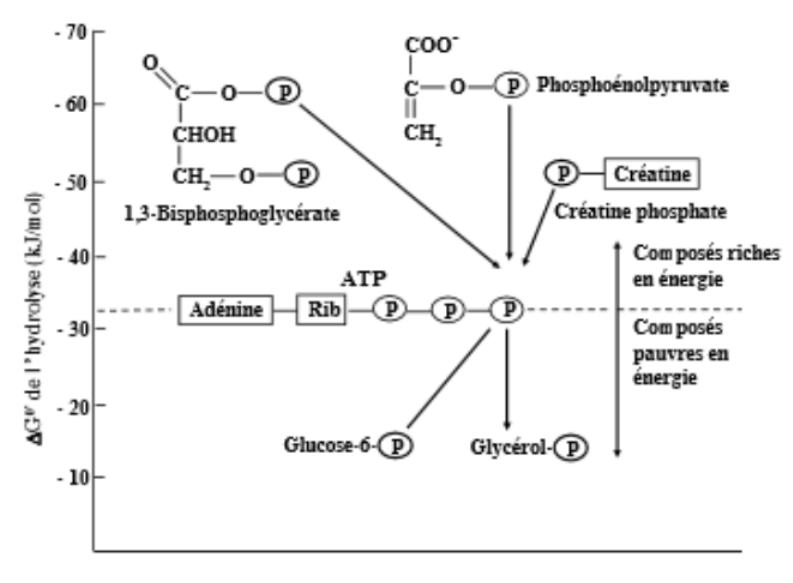
On définit le potentiel de transfert du groupement phosphate comme la capacité d’une molécule phosphorylée de réagir avec l’eau pour libérer son groupement phosphate.
Plus le ΔRG0‘ d’hydrolyse est important (très négatif), plus le potentiel de transfert est fort.
II. Production de la molécule d’ATP
En plein course, un humain consomme 2,5 kg d’ATP par minute, pour faire fonctionner ses muscles…
L’ATP est au centre du processus métabolique, il faut donc assurer en permanence sa production. Ce processus étant endergonique (anabolisme = production de molécule), il faut donc le coupler avec un processus exergonique. Quelles sont les stratégies disponibles ?
II.A. Phosphorylation directe au niveau du substrat
Les voies métaboliques produisent parfois des molécules phosphorylées possédant un potentiel de transfert de phosphate plus efficace que celui de l’ATP (voir figure précédente). L’ADP peut donc recevoir le phosphate de ces molécules pour refabriquer de l’ATP.
C’est le cas du phosphoénol-pyruvate (voie de la glycolyse).
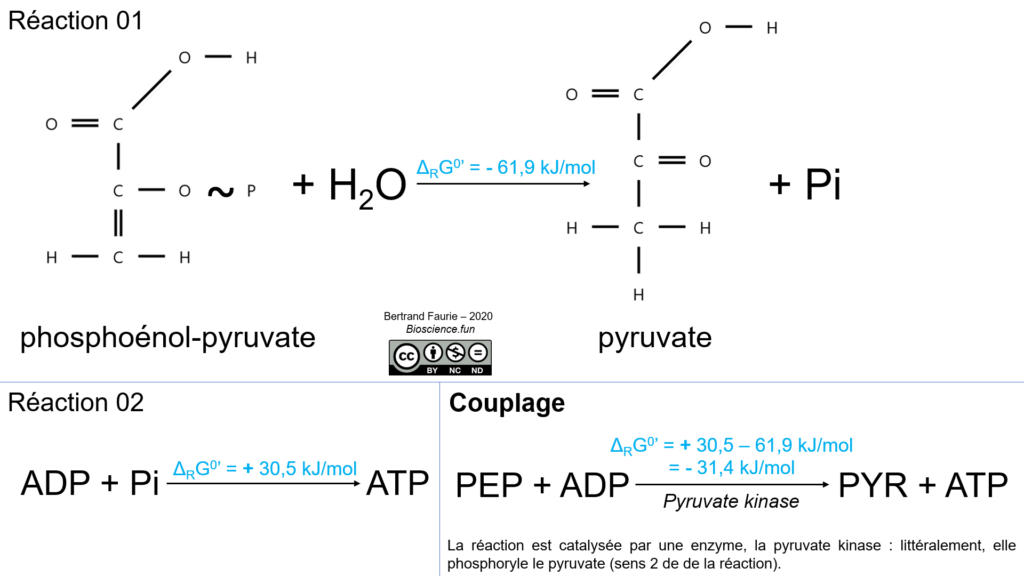
Il s’agit dans ce cas d’un couplage chimio-chimique !
II.B. La phosphorylation oxydative
Nous avons vu dans le sous-chapitre précédent que les réactions d’oxydoréduction pouvaient présenter un ΔRG0‘ très négatif, dépendant de la variation de E0 entre les deux couples oxydoréducteur mis en oeuvre. Toute cette énergie libérée peut évidemment être exploitée pour la régénération de l’ATP.
Au cours du métabolisme, de très nombreuses réactions sont des oxydations de substrat, avec un transfert d’électrons et de protons vers un cofacteur.
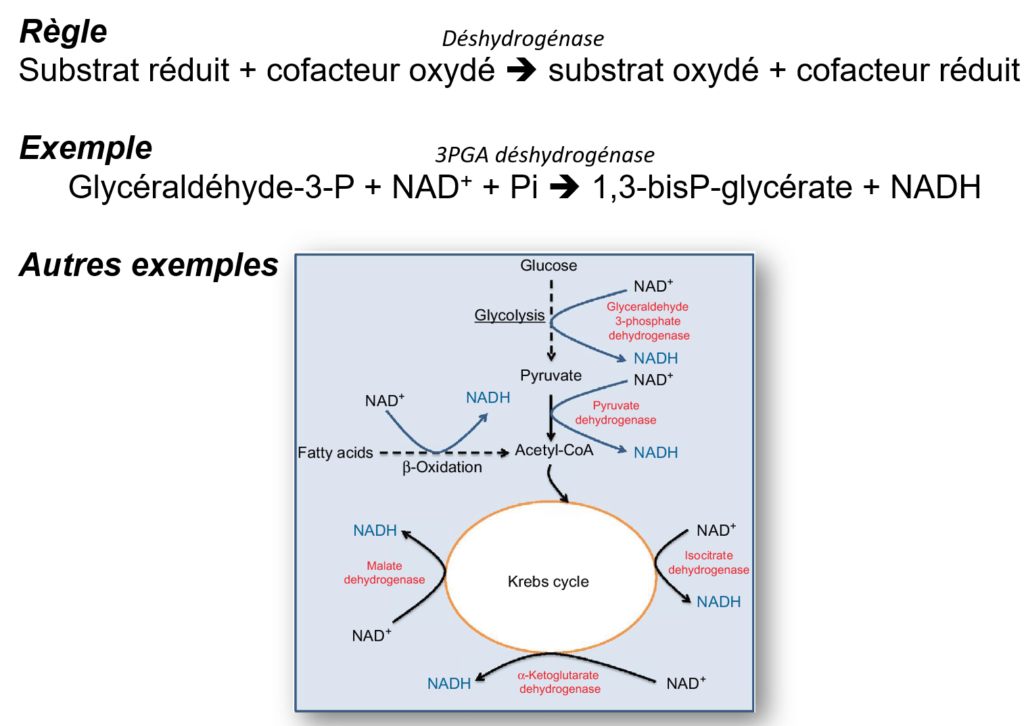
Les cofacteurs disponibles dans la cellule sont : NAD+/NADH,H+ ; NADP+/NADPH,H+ ; FAD/FADH2. Les réactions d’oxydoréduction sont réalisées par les déshydrogénases : elles enlèvent des hydrogènes.
Sauf que la cellule ne dispose que d’un stock limité de cofacteurs d’oxydoréduction : elle doit donc les régénérer. Cette opération complexe sera vue dans le sous-chapitre 03. Le processus de régénération des cofacteurs d’oxydoréduction au niveau de la chaîne respiratoire est très exergonique : il permet donc un couplage avec la régénération de l’ATP à partir d’ATP + Pi.
Exemple : la ré-oxydation du NADH,H+ en NAD+ présente un ΔRG0‘ = – 220 kJ/mol, ce qui est nettement suffisant pour assurer la régénération de l’ATP (+ 30,5 kJ/mol). Le reste de l’énergie n’est pas gaspillé : il sert à un couplage chimio-osmotique qui permet d’établir un gradient de concentration de protons = une force proton-motrice (voir sous-chapitre 03). Cette fpm permettra à son tour la régénération d’ATP (couplage osmo-chimique).
II.C. La photophosphorylation
Cette stratégie n’est employée que par les organismes phototrophes : qui utilisent la lumière comme source d’énergie.
L’énergie lumineuse est convertie en énergie chimique grâce à une chaîne de transporteurs d’électrons. Cette énergie, disponible en grande quantité, permet la régénération de l’ATP et la mise en place d’une force proton-motrice (couplage chimio-osmotique). Cette fpm permettra à son tour la régénération d’ATP (couplage osmo-chimique).
III. Utilisation de l’ATP comme « monnaie » énergétique universelle